题目内容
(2012?天津模拟)为改善大气质量,国家拟于“十二五”期间,力争将CO2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.
I.一种将CO2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l).
已知:H2(g)+
O2(g)=H2O(l)△H1=-285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
写出第③步反应的热化学方程式为
II.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.写出甲烷直接将NO2还原得到无污染的产物的化学方程式
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
该反应的化学平衡常数表达式为K=
.
在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示.
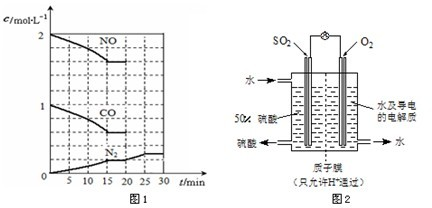
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
若20min时改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如图2,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的
I.一种将CO2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l).
已知:H2(g)+
| 1 |
| 2 |
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
写出第③步反应的热化学方程式为
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol
.II.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.写出甲烷直接将NO2还原得到无污染的产物的化学方程式
CH4+2NO2═N2+CO2+2H2O
CH4+2NO2═N2+CO2+2H2O
.(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
该反应的化学平衡常数表达式为K=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示.

若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
不
不
移动(填“向左”、“向右”或“不”).若20min时改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是
②
②
(填序号).①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如图2,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的
负
负
极(填“正”或“负”),负极反应式为SO2-2e-+2H2O=4H++SO42-
SO2-2e-+2H2O=4H++SO42-
.用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染.分析:I.已知H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l),先写出其方程式,根据盖斯定律计算其△H;
II.(1)甲烷直接将NO2还原得到氮气和二氧化碳,根据化合价升降法配平方程即可;
(2)依据平衡常数概念列式计算,依据浓度商和平衡常数比较分析判断,根据图象变化判断平衡移动及影响因素;
(3)本质为SO2与O2反应生成SO3以,SO3再与水化合生成硫酸,SO2在负极失电子发生氧化反应,生成SO42-.
II.(1)甲烷直接将NO2还原得到氮气和二氧化碳,根据化合价升降法配平方程即可;
(2)依据平衡常数概念列式计算,依据浓度商和平衡常数比较分析判断,根据图象变化判断平衡移动及影响因素;
(3)本质为SO2与O2反应生成SO3以,SO3再与水化合生成硫酸,SO2在负极失电子发生氧化反应,生成SO42-.
解答:解:I.已知:H2(g)+
O2(g)=H2O(l)△H1=-285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
H2O(l)=H2O(g)△H3=+44.0kJ/mol
根据盖斯定律△H=4△H1-△H2=-253.6kJ/mol;
第③步反应的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol;
II.(1)甲烷直接将NO2还原得到氮气和二氧化碳,其反应方程式为:CH4+2NO2═N2+CO2+2H2O,
故答案为:CH4+2NO2═N2+CO2+2H2O;
(2)依据图象分析,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;
平衡常数K=
=
=0.035,
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc=
=
=0.035=K,平衡不动,20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,斜率减小反应速率减小,氮气浓度增大平衡正移,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:
;不;②;
(3)该原电池的本质是2SO2+O2+2H2O=2H2SO4,SO2在负极上失电子,发生氧化反应电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:负;SO2-2e-+2H2O═SO42-+4H+.
| 1 |
| 2 |
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
H2O(l)=H2O(g)△H3=+44.0kJ/mol
根据盖斯定律△H=4△H1-△H2=-253.6kJ/mol;
第③步反应的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol;
II.(1)甲烷直接将NO2还原得到氮气和二氧化碳,其反应方程式为:CH4+2NO2═N2+CO2+2H2O,
故答案为:CH4+2NO2═N2+CO2+2H2O;
(2)依据图象分析,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;
平衡常数K=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| 0.2mol/L×(0.4mol/L)2 |
| (1.6mol/L)2×(0.6mol/L)2 |
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| 0.8×0.42 |
| 1.62×1.22 |
故答案为:
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
(3)该原电池的本质是2SO2+O2+2H2O=2H2SO4,SO2在负极上失电子,发生氧化反应电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:负;SO2-2e-+2H2O═SO42-+4H+.
点评:本题考查了热化学方程式和盖斯定律的计算应用,原电池的应用,化学平衡常数计算方法,平衡移动方向判断等,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?天津模拟)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
(2012?天津模拟)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )