题目内容
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
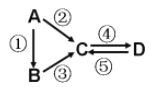
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式:__________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:_____________________________________________________。
(3)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:_________________________________________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:_____________________________________。
【答案】NaOH+CO2=NaHCO3 4NH3+5O2![]() 4NO+6H2O 2Fe3++Fe=3Fe2+ AlO+CO2+2H2O=Al(OH)3↓+HCO3-
4NO+6H2O 2Fe3++Fe=3Fe2+ AlO+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
根据题干信息及转化关系图分析各种物质的组成,再根据物质的性质书写化学方程式及离子方程式。
(1)若B是淡黄色固体,根据题干信息及转化关系知A为Na,C为氢氧化钠,D为碳酸氢钠,反应④的化学方程式:NaOH+CO2=NaHCO3;
故答案为:NaOH+CO2=NaHCO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,则B为NH3,C、D为NO、NO2,反应③的化学方程式:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若A是应用最广泛的金属,则A为铁,根据题干信息及转化关系知C为氯化铁,反应②⑤均用到的非金属单质是氯气,反应④是氯化铁与铁反应生成氯化亚铁,离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(4)若D物质具有两性,反应②③均要用强碱溶液,则A为Al,D为Al(OH)3,引起温室效应的主要气体为CO2,反应④是偏铝酸钠与二氧化碳的反应,离子方程式:AlO+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO+CO2+2H2O=Al(OH)3↓+HCO3-。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案


