题目内容
6.下列鉴别方法不可行的是( )| A. | 用水鉴别乙醇、苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、乙烯和己烷 |
分析 A.乙醇与水互溶,苯与水混合后有机层在上层,溴苯与水混合后有机层在下层;
B.乙醇燃烧有淡蓝色火焰,苯燃烧冒黑烟,四氯化碳不燃烧;
C.乙醇与碳酸钠互溶,乙酸与碳酸钠反应生成气体,乙酸乙酯与碳酸钠分层;
D.苯、己烷均与高锰酸钾不反应,分层现象相同.
解答 解:A.乙醇与水互溶,苯与水混合后有机层在上层,溴苯与水混合后有机层在下层,则现象不同,可鉴别,故A正确;
B.乙醇燃烧有淡蓝色火焰,苯燃烧冒黑烟,四氯化碳不燃烧,现象不同,可鉴别,故B正确;
C.乙醇与碳酸钠互溶,乙酸与碳酸钠反应生成气体,乙酸乙酯与碳酸钠分层,现象不同,可鉴别,故C正确;
D.苯、己烷均与高锰酸钾不反应,分层现象相同,不能检验,故D错误;
故选D.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、反应与现象等为解答的关键,侧重分析与实验能力的考查,注意现象相同不能检验物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.某有机物的结构如图所示,下列说法正确的是( )
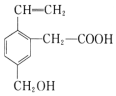

| A. | 有机物的分子式为C11H14O3 | |
| B. | 有机物中含有4种不同的官能团 | |
| C. | 0.5 mol 该有机物与足量NaOH溶液反应,消耗NaOH 1mol | |
| D. | 0.5 mol 该有机物与足量金属钠反应,能生成标准状况下的氢气11.2L |
17.下列对分子性质的解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键 | |
| B. | 乳酸有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释 | |
| D. | 酸性:HClO4>HClO,因为HClO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |
14.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2<t1):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和0.10 mol H2O,达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO和H2O转化率增大 | |
| D. | 温度升高至800℃,达到新平衡时n(CO2)=0.34 mol,则正反应为吸热反应 |
18.14C是一种放射性同位素,在一定条件下,14N可转变为14C,下列说法正确的是( )
| A. | 14C和14N互为同位素 | B. | 14N和C60是同素异形体 | ||
| C. | ${\;}_{6}^{14}$C核素中的中子数为8 | D. | 14CO2的摩尔质量为44 |
15.如图为元素周期表短周期的一部分,Z原子的电子层数 为n,最外层电子数为2n+1.下列叙述错误的是( )
| R | W | X | |
| Y | Z |
| A. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | X和Z氢化物的热稳定性和还原性均依次减弱 |
7.某学习小组利用如图装置进行电解氯化铵溶液的实验.其中X为铁,Y为石墨,a为wg质量分数为40%的NH4Cl(滴有酚酞).已知:①氧化性:Cl2>Br2>O2>I2,②NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2

(l)电解过程中,A 装置中可观察到的现象是X极产生无色气体,Y极产生黄绿色的气体,X极溶液变红.
(2)请选用上述仪器,组装一套检验产生氢气的装置:h→p→q→m→n→j→k→o[按气流方向(用“→”表示),用小写字母表示,装置不重复使用].
(3)某同学认为将E换成装有碱石灰的干燥管也可以达到相同效果,乙同学认为不合理,其理由是碱石灰不能除去混有的氨气,氨气与氧化铜反应产生水蒸气对实验干扰.
(4)设计实验检测阳极产生的气体成分(除水蒸气外).(所选的试剂用字母编号代替)限选试剂:
A、3mol/LNaOH溶液 B、品红 C、酸化的淀粉-KI溶液 D、KBr溶液
(5)电解结束后,加热电解液将NH3完全蒸出,并用水吸收形成200.00mL溶液,取出其中的20.00mL加指示剂后用标准浓度为c mol/L的盐酸溶液滴定,消耗盐酸V mL,则电解制得NH3的产率$\frac{107cV}{80w}$(用化简为整数的含w、c、V的代数式表示).
(6)若实验时反接了正负极,则X极的电极方程式为Fe-2e-=Fe2+.

(l)电解过程中,A 装置中可观察到的现象是X极产生无色气体,Y极产生黄绿色的气体,X极溶液变红.
(2)请选用上述仪器,组装一套检验产生氢气的装置:h→p→q→m→n→j→k→o[按气流方向(用“→”表示),用小写字母表示,装置不重复使用].
(3)某同学认为将E换成装有碱石灰的干燥管也可以达到相同效果,乙同学认为不合理,其理由是碱石灰不能除去混有的氨气,氨气与氧化铜反应产生水蒸气对实验干扰.
(4)设计实验检测阳极产生的气体成分(除水蒸气外).(所选的试剂用字母编号代替)限选试剂:
A、3mol/LNaOH溶液 B、品红 C、酸化的淀粉-KI溶液 D、KBr溶液
| 操作 | 现象和结论 |
| 将混合气体依次通入D(或B),足量的A,然后通入C | D变黄色(或B褪色),则混合气体有氯气;C变蓝,则混合气体含的氧气 |
(6)若实验时反接了正负极,则X极的电极方程式为Fe-2e-=Fe2+.
 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.
