题目内容
(9分)将0.1mol的镁铝混合物溶于100mL 2 mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答:

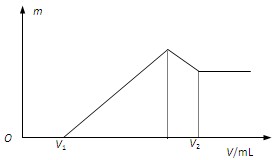
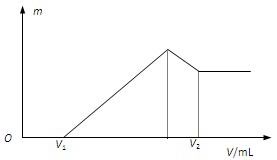
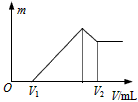
(1) 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=160mL时,则金属粉末中,n(Mg)=?(要求写计算过程)
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V (NaOH)=_______mL?
【答案】
(1)0.06mol (2)400
【解析】
试题分析:(1)与NaOH反应的H2SO4的量为: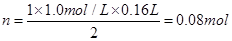 ,因此与镁铝混合物反应的H2SO4的量为
,因此与镁铝混合物反应的H2SO4的量为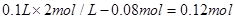 。
。
设镁铝混合物中镁、铝的物质的量分别为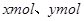 ,由反应化学方程式得以下关系式:
,由反应化学方程式得以下关系式:
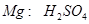
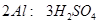
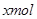
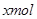
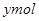
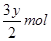
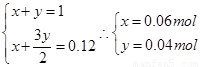
因此n(Mg)=0.06mol。
(2)由方程式可得以下关系式:
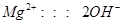
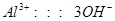
0.06mol 0.12mol 0.04mol 0.12mol、
因此所需NaOH的体积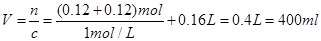
考点:金属及其化合物的计算
点评:考查相关计算,属于基础题。只要掌握好物质之间的相关反应,不难列出关系式,从而得出正确答案。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目