题目内容
氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理.(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,试书写完成如下反应的化学方程式:
在反应①中氧化剂是
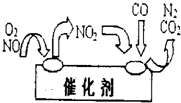
(2)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NO、NO2和碳氢化合物等废气.在转换器的前半部,CO和氮氧化物(NOx)在催化剂的作用下发生反应,生成CO2

和N2;在转换器的后半部,残余的烃和尚未反应的CO在催化剂的作用下被氧化生成CO2和H2O.写出在催化转换器的前半部所发生反应的化学方程式(氮氧化物以NOx表示):
(3)氨气亦可用来处理氮氧化物.例如,氨气与二氧化氮发生反应生成一种常温下无色、无味、无毒的气体和无色、无毒的液体.若某工厂排出的气体中二氧化氮的含量0.5%(体积分数),则处理1×103m3(标准状况)这种尾气,需要多少升氨气?
分析:(1)根据氧化还原反应中氧化剂、还原剂之间得失电子数目相等以及质量守恒定律配平方程式;
(2)氮氧化物和CO反应生成二氧化碳和氮气,发生氧化还原反应;
(3)反应的方程式为,结合反应的方程式计算.
(2)氮氧化物和CO反应生成二氧化碳和氮气,发生氧化还原反应;
(3)反应的方程式为,结合反应的方程式计算.
解答:解:(1)在反应①中,NO2中N元素化合价降低,被还原,化合价由+4价降低到+3价,则NO2为氧化剂,NO中N元素化合价升高,被氧化,化合价由+2价升高到+3价,则NO为还原剂,反应的方程式应为NO2+NO+2NaOH=2NaNO2+H2O,
在反应②中,只有N元素化合价发生变化,N元素化合价分别由+4价升高到+5价、降低到+3价,NO2既是氧化剂又是还原剂,由氧化剂、还原剂得失电子数目相等可知反应的方程式为2NO2+2NaOH=NaNO2+NaNO3+H2O,
故答案为:1,1,2,2,H2O;2,2,1,1,H2O;NO2;NO2;
(2)该反应中反应物是氮氧化物和一氧化碳,生成物是氮气和二氧化碳,反应条件是催化剂和加热,所以该反应方程式为:2NOx+2xCO
N2+2xCO2,
故答案为:2NOx+2xCO
N2+2xCO2;
(3)发生反应为8NH3+6NO2═7N2+12H20,
工厂排出的气体中二氧化氮为1×103m3×0.5%=5m3=5000L,
由8NH3+6NO2═7N2+12H20,可知需要氨气5000L×
=6.67×103L.
故答案为:6.67×103L.
在反应②中,只有N元素化合价发生变化,N元素化合价分别由+4价升高到+5价、降低到+3价,NO2既是氧化剂又是还原剂,由氧化剂、还原剂得失电子数目相等可知反应的方程式为2NO2+2NaOH=NaNO2+NaNO3+H2O,
故答案为:1,1,2,2,H2O;2,2,1,1,H2O;NO2;NO2;
(2)该反应中反应物是氮氧化物和一氧化碳,生成物是氮气和二氧化碳,反应条件是催化剂和加热,所以该反应方程式为:2NOx+2xCO
| ||
| △ |
故答案为:2NOx+2xCO
| ||
| △ |
(3)发生反应为8NH3+6NO2═7N2+12H20,
工厂排出的气体中二氧化氮为1×103m3×0.5%=5m3=5000L,
由8NH3+6NO2═7N2+12H20,可知需要氨气5000L×
| 8 |
| 6 |
故答案为:6.67×103L.
点评:本题以氮的氧化物的性质为载体综合考查化学方程式的有关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意能正确书写方程式是解本题关键,难度不大.

练习册系列答案
相关题目

 火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题: