题目内容
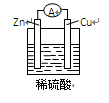
在盛有500mL 1.4mol/L H2SO4溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:
(1)写出电极反应式:负极______________________;正极_______________________。
(2)电极上共析出氢气的质量为 克。
(1)写出电极反应式:负极______________________;正极_______________________。
(2)电极上共析出氢气的质量为 克。
(1)Zn — 2e- = Zn2+ 2H+ + 2e- = H2↑ (2)0.2
(1)电极反应:负极:Zn — 2e- = Zn2+ 正极:2H+ + 2e- = H2↑
(2) 电极锌消耗6.5g,即0.1mol锌反应,生成0.1mol氢气,所以析出氢气的质量为0.2g
(2) 电极锌消耗6.5g,即0.1mol锌反应,生成0.1mol氢气,所以析出氢气的质量为0.2g

练习册系列答案
相关题目
 浓度增大
浓度增大


