题目内容
【题目】某课外小组在实验室用二氧化锰和浓盐酸共热制备氯气,并进行氯气性质的研究。
(1)该小组同学欲用下图所示仪器及试剂制备并收集纯净、干燥的氯气。
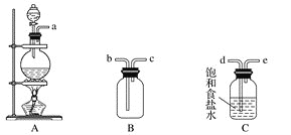
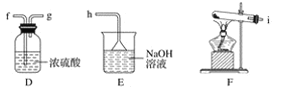
①用不到的仪器是________(填大写字母)
②将各仪器按先后顺序连接起来,应该是:___________(用导管口处的字母表示)。
③浓盐酸与二氧化锰反应的离子方程式_____________
④ C的作用___________,D的作用_______,E中倒置漏斗的作用是_________
(2)该小组同学设计如下所示装置探究氯气的氧化性。
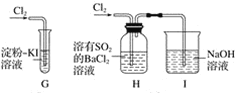
① 通少量Cl2时,G中的现象是_______,原因是_________(用化学方程式表示)
② H中的现象是__________________。
③ 烧杯中NaOH溶液的作用是______________
【答案】F adcfgbch MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑+ 2H2O 除去Cl2中的HCl 干燥氯气 防止倒吸 溶液变蓝色 Cl2 + 2KI = 2KCl + I2 出现白色沉淀 吸收Cl2,防止污染空气
Mn2+ + Cl2↑+ 2H2O 除去Cl2中的HCl 干燥氯气 防止倒吸 溶液变蓝色 Cl2 + 2KI = 2KCl + I2 出现白色沉淀 吸收Cl2,防止污染空气
【解析】
根据图示结合实验目的可知,实验室用二氧化锰和浓盐酸共热制备氯气应该选用装置A;反应制得的氯气中会含有氯化氢和水蒸气等杂质,在实验前需要除杂,可以选择C除去氯化氢,选择D除去水蒸气;装置B可以收集氯气;装置E可以吸收尾气中氯气,防止污染,结合氯气的性质分析解答。
(1)①根据上述分析,装置A为制备氯气的装置,装置C除去氯化氢,装置D除去水蒸气;装置B收集氯气;装置E吸收尾气中氯气,防止污染,用不到的仪器是装置F,故答案为:F;
②根据上述分析,各仪器连接的先后顺序为adcfgbch,故答案为:adcfgbch;
③浓盐酸与二氧化锰反应的离子方程式为MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑+ 2H2O,故答案为:MnO2 + 4H+ + 2Cl-
Mn2+ + Cl2↑+ 2H2O,故答案为:MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑+ 2H2O;
Mn2+ + Cl2↑+ 2H2O;
④ 根据上述分析,C的作用为除去Cl2中的HCl,D的作用为干燥氯气,E中倒置漏斗可以防止倒吸,故答案为:除去Cl2中的HCl;干燥氯气;防止倒吸;
(2)① 通少量Cl2时,氯气与碘化钾发生置换反应,Cl2 + 2KI = 2KCl + I2,碘遇到淀粉变蓝色,故答案为:溶液变蓝色;Cl2 + 2KI = 2KCl + I2;
② 氯气具有强氧化性,能够将亚硫酸氧化生成硫酸,硫酸与氯化钡溶液反应生成硫酸钡白色沉淀,故答案为:出现白色沉淀;
③氯气有毒,烧杯中NaOH溶液可以吸收多余的氯气,防止污染,故答案为:吸收Cl2,防止污染空气。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案