题目内容
(8分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。

(1)氢气在燃烧时,放出大量热量,说明该反应是_________________热反应,这是由于反应物的总能量_________________生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量__________________________________________________形成产物的化学键放出的总能量。
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2 g氢气燃烧时放出286 kJ热量,而每千克汽油燃烧时放出的热量为46000 kJ。试据此分析氢气作为能源代替汽油的优势:_____________________________________________________________________________。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,右图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是_________________ (填“a电极”或“b电极”),在负极发生的电极反应是_________________,电池反应为_________________。

(1)氢气在燃烧时,放出大量热量,说明该反应是_________________热反应,这是由于反应物的总能量_________________生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量__________________________________________________形成产物的化学键放出的总能量。
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2 g氢气燃烧时放出286 kJ热量,而每千克汽油燃烧时放出的热量为46000 kJ。试据此分析氢气作为能源代替汽油的优势:_____________________________________________________________________________。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,右图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是_________________ (填“a电极”或“b电极”),在负极发生的电极反应是_________________,电池反应为_________________。
(1)放 大于 小于
(2)洁净无污染,可用水制取氢气,来源广泛,燃烧相同质量的燃料,氢气放出的热量多
(3) b电极 H2-2e-====2H+ 2H2+O2====2H2O
(2)洁净无污染,可用水制取氢气,来源广泛,燃烧相同质量的燃料,氢气放出的热量多
(3) b电极 H2-2e-====2H+ 2H2+O2====2H2O
H2、O2电池的形成,在于反应2H2+O2====2H2O反应可发生。电池的负极H2失电子,正极O2得电子,故负极为a,正极为b,负极反应:H2-2e-====2H+,正极反应为O2+2H2O+4e-====4OH-,总反应式为2H2+O2====2H2O。

练习册系列答案
相关题目
 2H2↑+O2↑。下列说法正确的是( )
2H2↑+O2↑。下列说法正确的是( )
 、
、 、
、 、
、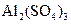 、
、 五种物质中:
五种物质中: 分子中,含17×6.02×
分子中,含17×6.02× 个共用电子对
个共用电子对 的浓硫酸与90 mL蒸馏水混合,所得溶液中
的浓硫酸与90 mL蒸馏水混合,所得溶液中 =3.68 mol·
=3.68 mol· 溶液与pH=10的
溶液与pH=10的 溶液中,水电离出的
溶液中,水电离出的 溶液中,滴入0.1 mol·
溶液中,滴入0.1 mol· 溶液至混合溶液pH=7时,则滴加
溶液至混合溶液pH=7时,则滴加