题目内容
【题目】元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
(1)Y与Z可形成多种化合物. ①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]. ①基态X2+的电子排布式是 .
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 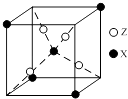
【答案】
(1)O;三角锥形;SeO2
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能
(3)1s22s22p63s23p63d6;14mol
(4)Fe3S8
【解析】解:元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2 , 则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4 , 则Z为S元素.(1)①同主族自上而下电负性减小,故电负性O>S,所以答案是:O;②离子SO32﹣中S原子孤电子对数= ![]() =1,价层电子对数=3+1=4,为三角锥形,所以答案是:三角锥形;③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2等,所以答案是:SeO2;(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,所以答案是:H2O分子与乙醇分子间可形成氢键,而H2S不能;(3)①基态Fe2+的电子排布式是:1s22s22p63s23p63d6 , 所以答案是:1s22s22p63s23p63d6;②氨气分子中有3个σ键,CN﹣中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,所以答案是:14mol;(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4×
=1,价层电子对数=3+1=4,为三角锥形,所以答案是:三角锥形;③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2等,所以答案是:SeO2;(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,所以答案是:H2O分子与乙醇分子间可形成氢键,而H2S不能;(3)①基态Fe2+的电子排布式是:1s22s22p63s23p63d6 , 所以答案是:1s22s22p63s23p63d6;②氨气分子中有3个σ键,CN﹣中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,所以答案是:14mol;(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4× ![]() =1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8 , 所以答案是:Fe3S8 .
=1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8 , 所以答案是:Fe3S8 .

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案