题目内容
在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
(1)氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为?2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl
(5)该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
(1)氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为?2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl
 ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl

(5)该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
(1)2 1s22s22p63s23p6
(2)原子 Si3N4
(3)c
(4)NaCl H2O (漏写不给分) 5NaClO2 +4HCl
(5)1∶4 0.2
(6) (或3.85a)
(或3.85a)
(2)原子 Si3N4
(3)c
(4)NaCl H2O (漏写不给分) 5NaClO2 +4HCl
(5)1∶4 0.2
(6)
 (或3.85a)
(或3.85a)试题分析:(1)氯元素原子最外电子层电子排布式为3S2P5,共有2种能量不同的电子,该元素的简单阴离子核外电子排布式是[Ne]3S23P6。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,说明熔点很高,属于原子晶体,根据化合价,该化合物的化学式 Si3N4。
(3)a.不能通过Cl原子最外层电子数比氧多,只能通过得电子的难易来说明,错误;b应是最高价氧化物对应水化物的酸性强弱对比,而不是氢化物水溶液的酸性对比,错误;c.ClO2中氯元素为+4价,氧元素为?2价,说明氧得电子强于氯,故氯显正价,正确;d.沸点不能说明,错误;
(4)根据化合价升降法和原子守恒,5 NaClO2 +4HCl
 4ClO2↑+5NaCl+ 2H2O 。
4ClO2↑+5NaCl+ 2H2O 。(5)该反应中氧化剂和还原剂都是NaClO2,两者物质的量之比是1:4。生成0.2 mol ClO2转移电子的物质的量为 0.2 mol。
(6)根据题中信息,写出2ClO2+2CN-→2CO2 + N2+ 2Cl-根据电子守恒,ClO2 与CN-物质的量相等,即为
 (或3.85a)。
(或3.85a)。
练习册系列答案
相关题目
 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( ) 的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使
的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: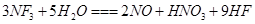 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是 是还原剂
是还原剂 非极性分子,在潮湿空气中泄漏会看到红棕色气体
非极性分子,在潮湿空气中泄漏会看到红棕色气体 个电子
个电子