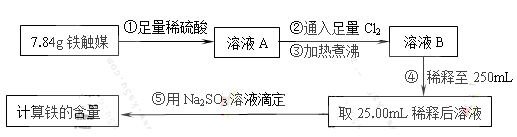
题目内容
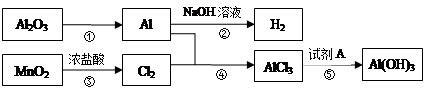
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: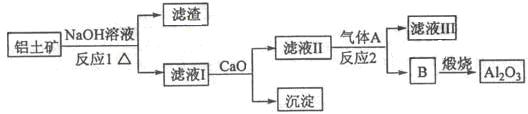
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: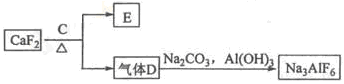
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
(1)2NaOH+SiO2=Na2SiO3+H2O(2分) 2NaOH+Al2O3=2NaAlO2+H2O(2分)
(2)CaSiO3(2分) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(2分)
(3)浓H2SO4(1分) 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(2分)
(4)2Al2O3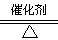 4Al+3O2↑(2分) O2、CO2(CO)(2分)
4Al+3O2↑(2分) O2、CO2(CO)(2分)
解析试题分析:(1)反应1为“碱溶”,发生的反应为:2NaOH+SiO2=Na2SiO3+H2O,2NaOH+Al2O3=2NaAlO2+H2O;(2)滤液I的主要成分是NaAlO2和Na2SiO3,加入生石灰发生的反应:CaO+H2O=Ca(OH)2和Ca(OH)2+Na2SiO3=CaSiO3+ 2NaOH,即沉淀为CaSiO3。滤液II的主要成分是NaAlO2,通入的气体A是CO2,发生反应的方程式为2NaAlO2+CO2+3H2O=2A l ( O H )3↓+Na2CO3;(3)根据生成物可以作为建筑材料以及加入C能和CaF2发生反应,可知C是浓硫酸,反应的方程式为CaF2+H2SO4(浓)=CaSO4+2HF;(4)电解法制铝的方程式为2Al2O3 4Al+3O2↑,阳极产生的气体是O2。
4Al+3O2↑,阳极产生的气体是O2。
考点:考查实验基本操作,元素化合物性质及其转化关系,

某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下: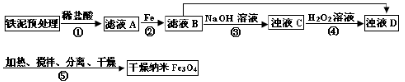
|
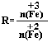 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。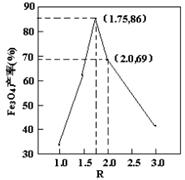
(1)步骤②中,主要反应的离子方程式是______。
(2)已知:Fe3+在pH=2.8时沉淀完全; Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是______。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是______。
(4)下列说法正确的是______(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,n(FeOOH)/n(Fe2+)="2:1"
d.当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率最高
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。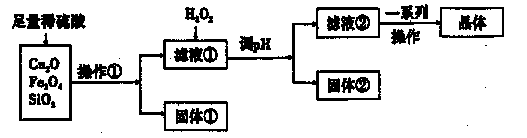
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下: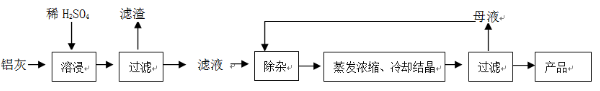
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的 ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式 ;
③Ⅲ中加入MnSO4的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 (填化学式)。

 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
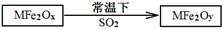
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。