题目内容
两份不同浓度的NaOH溶液各500mL,分别吸收1120mL(标准状况下体积)SO2气体,反应后溶液中分别有5.75g和7.10g溶质。求两份NaOH溶液的物质的量浓度。
0.150mol/L、0.240mol/L。
解答本题时,一要挖掘隐含的两个反应;二要运用平均值规律通过对“5.75g”和“7.10g”的量的分析,判断溶质的组成。
SO2与NaOH作用可能的反应有:
SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3。
1120mLSO2气体可生成0.0500molNa2SO3或NaHSO3,质量是6.30g或5.20g。依题意,两份溶液中,含溶质5.75g的一定含Na2SO3和NaHSO3;含溶质7.10g的一定含Na2SO3和NaOH。
设第一份溶液中含Na2SO3物质的量为x,NaHSO3物质的量为y,则:
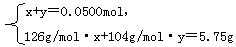
解得 x=0.0250mol,y=0.0250mol。
原溶液中含NaOH物质的量为:
2x+y=0.0750mol,
c(NaOH)=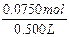 =0.150mol/L。
=0.150mol/L。
依上分析,第二份溶液中含Na2SO30.0500mol,质量是6.30g,则含NaOH的质量为:m(NaOH)=7.10g-6.30g=0.80g。
原溶液中含NaOH物质的量为:
2×0.0500mol+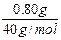 =0.120mol,
=0.120mol,
c(NaOH)=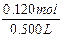 =0.240mol/L。
=0.240mol/L。
SO2与NaOH作用可能的反应有:
SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3。
1120mLSO2气体可生成0.0500molNa2SO3或NaHSO3,质量是6.30g或5.20g。依题意,两份溶液中,含溶质5.75g的一定含Na2SO3和NaHSO3;含溶质7.10g的一定含Na2SO3和NaOH。
设第一份溶液中含Na2SO3物质的量为x,NaHSO3物质的量为y,则:
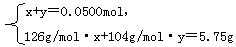
解得 x=0.0250mol,y=0.0250mol。
原溶液中含NaOH物质的量为:
2x+y=0.0750mol,
c(NaOH)=
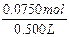 =0.150mol/L。
=0.150mol/L。依上分析,第二份溶液中含Na2SO30.0500mol,质量是6.30g,则含NaOH的质量为:m(NaOH)=7.10g-6.30g=0.80g。
原溶液中含NaOH物质的量为:
2×0.0500mol+
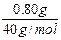 =0.120mol,
=0.120mol,c(NaOH)=
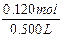 =0.240mol/L。
=0.240mol/L。
练习册系列答案
相关题目