题目内容
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是由 转化为 ,在导线中电流方向为 → (用a、b 表示)。
(2)正极反应式为 ,负极发生 反应(填“氧化”或“还原”)。
(3)氢氧燃料电池的能量转化率 100%(填<、>、=)。
(4)电极表面镀铂粉的原因为 。
(12分)(1)化学能转化为电能 b→a
(2)O2+2H2O+4e-=4OH- 氧化
(3)<
(4)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
解析试题分析:(1)该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电流从正极流向负极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电流从b到a,故答案为:化学能转化为电能;从b到a;
(2)燃料电池中,通入燃料氧气的电极是正极,反应式为O2+2H2O+4e-=4OH-,通入燃料氢气的电极是负极,通氧气的电极是正极,故答案为:负;
(3)在反应过程中会有部分能力损失,故氢氧燃料电池的能量转化率<100%;
(4)根据题目信息:“电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定”,可知电极表面镀铂粉的原因为增大气体的吸附面积,保证气体充分参与电极反应,故答案为:增大气体的吸附面积,保证气体充分参与电极反应。
考点:常见化学电源的种类及其工作原理
点评:本题考查学生燃料电池中的有关知识,可以根据所学知识来回答,难度不大。

 阅读快车系列答案
阅读快车系列答案 AgOH+H+
AgOH+H+
 门上的固体材料R可以采用
门上的固体材料R可以采用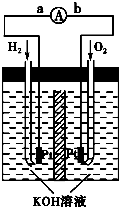 方向为
方向为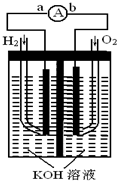 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: 氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
 氢氧燃料电池是符合绿色化学理念的新型 发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型 发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定,请回答: