题目内容
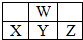 如图是周期表中短周期的一部分.已知X原子最外层电子数比次外层电子数少3个,Z的单质是黄绿色气体.则下列说法中正确的是( )
如图是周期表中短周期的一部分.已知X原子最外层电子数比次外层电子数少3个,Z的单质是黄绿色气体.则下列说法中正确的是( )| A、X的氢化物比Z的氢化物稳定 |
| B、原子半径的大小顺序是 X>Y>W |
| C、X、Y、Z各元素最高价和最低价的绝对值之和为8 |
| D、X、Y、Z最高价氧化物对应水化物的酸性强弱关系X>Y>Z |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z都是短周期元素,根据元素在周期表中的位置知,W是第二周期元素,X、Y、Z属于第三周期元素,X原子最外层电子数比次外层电子数少3,则其最外层电子数是5,则X是P元素,所以Y是S、W是O、Z是Cl元素.
A.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.第三周期主族元素,元素最高价等于最外层电子数、最低价负化合价=最外层电子数-8;
D.同周期自左而右元素非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强.
A.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.第三周期主族元素,元素最高价等于最外层电子数、最低价负化合价=最外层电子数-8;
D.同周期自左而右元素非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强.
解答:
解:W、X、Y、Z都是短周期元素,根据元素在周期表中的位置知,W是第二周期元素,X、Y、Z属于第三周期元素,X原子最外层电子数比次外层电子数少3,则其最外层电子数是5,则X是P元素,所以Y是S、W是O、Z是Cl元素,则:
A.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定,故Z的氢化物比X的氢化物稳定,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径X>Y>W,故B正确;
C.X、Y、Z元素最高价等于最外层电子数、最低价负化合价=最外层电子数-8,故最高价和最低价的绝对值之和为8,故C正确;
D.同周期自左而右元素非金属性增强,故非金属性X<Y<Z,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性X<Y<Z,故D错误,
故选BC.
A.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定,故Z的氢化物比X的氢化物稳定,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径X>Y>W,故B正确;
C.X、Y、Z元素最高价等于最外层电子数、最低价负化合价=最外层电子数-8,故最高价和最低价的绝对值之和为8,故C正确;
D.同周期自左而右元素非金属性增强,故非金属性X<Y<Z,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性X<Y<Z,故D错误,
故选BC.
点评:本题考查结构位置性质关系、元素周期律等,比较基础,注意整体把握元素周期表的结构与元素周期律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于苯的说法中,不正确的是( )
| A、分子中含有三个C-C键和三个C=C键 |
| B、在空气中燃烧时产生较多的黑烟 |
| C、分子中C、H元素的质量为12:1 |
| D、在一定条件下可与氢气发生加成反应 |
在氯化铁和盐酸的混合溶液中,已知c(Cl-)═a mol/L,pH═b<1,则溶液中c(Fe3+)为( )
A、
| ||
| B、(a-1×10-b) mol/L | ||
C、(a-
| ||
| D、上述答案都不正确 |
下列说法正确的是( )
| A、铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
| B、硅在电子工业中是最重要的半导体材料,广泛用于制作光导纤维 |
| C、二氧化硫是一种有毒气体,所以不能用于杀菌消毒 |
| D、氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
 如图表示反应2A(g)?B(g)+C(g)△H>0从平衡状态Ⅰ移到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化可能为( )
如图表示反应2A(g)?B(g)+C(g)△H>0从平衡状态Ⅰ移到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化可能为( )| A、加入催化剂 | B、加压 |
| C、增加A的浓度 | D、增加B的浓度 |
某温度下,对可逆反应2X(g)+Y(g)?3Z(g)+W(s)△H>0 的叙述正确的是( )
| A、加入少量W,逆反应速率增大,平衡向左移动 |
| B、增大压强,正反应速率增大,逆反应速率减小 |
| C、温度、体积不变,充入He气增大压强,反应速率会加快 |
| D、升高温度,混合气体的平均相对分子质量减小 |
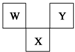 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A、三种元素的原子半径的大小顺序是W<Y<X |
| B、X元素的氧化物、氢化物的水溶液都呈酸性 |
| C、Y元素的单质是非金属单质中唯一能跟水发生激烈反应的单质 |
| D、W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 |
把物质的量均为0.1mol的CuCl2和H2SO4溶于水制成200mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同(假设溶液体积不变).则下列描述正确的是( )
| A、电路中共转移1.2NA个电子 |
| B、阳极得到的气体中O2的物质量为0.2mol |
| C、阴极质量增加3.2g |
| D、电解后剩余硫酸溶液的浓度为0.5 mol?L-1 |