题目内容
20.欲配制100mL1.0mol/LCuSO4溶液,正确的方法是( )| A. | 将16.0g CuSO4溶于100mL水中 | |
| B. | 将25.0g CuSO4•5H2O溶于少量水中,再用水稀释至100mL | |
| C. | 将20mL5.0mol/L CuSO4溶液用水稀释至100mL | |
| D. | 在20mL5.0mol/L CuSO4溶液中加入80mL水 |
分析 A.16.0g CuSO4物质的量为0.1mol,溶于水配成100mL溶液,所得溶液浓度为0.1mol/L;
B.根据n=cV计算硫酸铜物质的量,CuSO4•5H2O的物质的量等于硫酸铜物质的量,根据m=nM计算 CuSO4•5H2O的质量;
C.根据稀释定律计算判断;
D.稀释后溶液的体积不是100mL.
解答 解:A.16.0g CuSO4物质的量为$\frac{16g}{160g/mol}$=0.1mol,不是溶剂的体积为100mL,而是溶于水配成100mL溶液,所得溶液浓度为0.1mol/L,故A错误;
B.硫酸铜物质的量为0.1L×1mol/L=0.1mol,CuSO4•5H2O的物质的量等于硫酸铜物质的量,故需要 CuSO4•5H2O的质量为0.1mol×250g/mol=25.0g,故B正确;
C.根据稀释定律,稀释100mL后溶液浓度为$\frac{20mL×5.0mol/L}{100mL}$=1.0mol/L,故C正确;
D.稀释后溶液的体积不是100mL,故D错误,
故选:BC.
点评 本题考查溶液配制,侧重物质的量浓度有关计算,注意对定义式的理解与灵活应用.

练习册系列答案
相关题目
10.不能使KI淀粉溶液显蓝色的物质是( )
| A. | I2 | B. | KI | C. | NO2 | D. | Cl2 |
11.把Na2SO4放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( )
| A. | H2 | B. | Ag | C. | O2 | D. | Cl2 |
8.两个体积相同的密闭容器一个盛有氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的( )
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 分子总数 |
12.某无色溶液中,下列离子中能大量共存的一组为( )
| A. | K+、Mg2+、Cl-、OH- | B. | K+、Cu2+、SO42-、Na+ | ||
| C. | NH4+、CO32-、NO3-、Na+ | D. | NH4+、Cl-、HCO3-、H+ |
10.下列对碱金属性质的叙述中,不正确的是( )
| A. | 都是银白色的柔软金属(除铯外) | |
| B. | 密度都比较小 | |
| C. | 碱金属单质都与水剧烈反应 | |
| D. | 单质的熔、沸点随原子序数的增加而升高 |
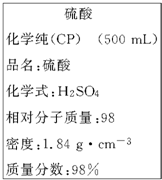 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有: