题目内容
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______.

(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据上图回答下列问题:
①P和Cl2反应生成PCl3的热化学方程式______;
②PCl5分解成PCl3和Cl2的热化学方程式是______;
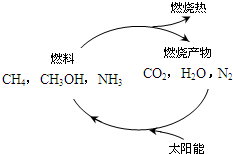
(3)科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇(CH3OH)为燃料的燃料电池.已知:
CO(g)+
O2(g)=CO2(g);△H=-283.0kJ?mol-1;
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ?mol-1.
请回答下列问题:
液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______
(4)已知稀溶液中,H2SO4与1molNaOH溶液恰好完全反应时,放出57.3kJ热量,写出表示H2SO4与NaOH反应的热化学方程式______.
(5)25℃、101kPa条件下充分燃烧一定量的甲烷气体生成CO2气体和液态水,放出热量为QkJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出甲烷燃烧的热化学方程式______.
(6)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
写出常温常压下氢气与氯气反应的热化学方程式______;该反应中氢气与氯气的总能量______(填“大于”、“等于”、“小于”)氯化氢的总能量.

(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据上图回答下列问题:
①P和Cl2反应生成PCl3的热化学方程式______;
②PCl5分解成PCl3和Cl2的热化学方程式是______;
(3)科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇(CH3OH)为燃料的燃料电池.已知:
CO(g)+
| 1 |
| 2 |
CH3OH(l)+
| 3 |
| 2 |
请回答下列问题:
液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______
(4)已知稀溶液中,H2SO4与1molNaOH溶液恰好完全反应时,放出57.3kJ热量,写出表示H2SO4与NaOH反应的热化学方程式______.
(5)25℃、101kPa条件下充分燃烧一定量的甲烷气体生成CO2气体和液态水,放出热量为QkJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出甲烷燃烧的热化学方程式______.
(6)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
| 化学键 | H-H | Cl-Cl | H-Cl |
| 生成1mol化学键时放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
(1)反应热为134kJ/mol-368kJ/mol=-234kJ/mol,反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;
(2)①根据图示可知:P(s)+
Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)=PCl3(g)△H=-306 kJ/mol,
故答案为:P(s)+
Cl2(g)=PCl3(g)△H=-306kJ?mol-1;
②根据图示可知:Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,反应热为△H=-93 kJ/mol,所以PCl5(g)=PCl3(g)+Cl2(g)是吸热反应,热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ/lmol;
(3)①CO(g)+
O2(g)=CO2(g);△H=-283.0kJ?mol-1;
②CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(4)H2SO4与1mol NaOH溶液恰好完全反应时,放出57.3kJ热量,则H2SO4与1mol NaOH溶液恰好完全反应时,放出114.6kJ热量,热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(aq)△H=-114.6kJ?mol-1;
故答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(aq)△H=-114.6kJ?mol-1;
(5)n(CaCO3)=
=0.25mol,
Ca(OH)2+CO2=CaCO3+H2O
1 1
0.25mol 0.25mol
即甲烷燃烧生成的二氧化碳为0.25mol.
CH4 +2O2 =CO2+2H2O
0.25mol 0.25mol
即0.25mol甲烷放出的热量为Q,所以1mol甲烷放出的热量为4Q,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-4QkJ?mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-4QkJ?mol-1;
(6)在反应CH4(g)+4F2(g)=CF4(g)+4HF(g)中,△H=436kJ/mol+243kJ/mol-431kJ/mol×2-183kJ?mol-1,热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183kJ?mol-1,该反应放热,氢气与氯气的总能量大于氯化氢的总能量,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ?mol-1;大于.
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;
(2)①根据图示可知:P(s)+
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:P(s)+
| 3 |
| 2 |
②根据图示可知:Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,反应热为△H=-93 kJ/mol,所以PCl5(g)=PCl3(g)+Cl2(g)是吸热反应,热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ/lmol;
(3)①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(4)H2SO4与1mol NaOH溶液恰好完全反应时,放出57.3kJ热量,则H2SO4与1mol NaOH溶液恰好完全反应时,放出114.6kJ热量,热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(aq)△H=-114.6kJ?mol-1;
故答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(aq)△H=-114.6kJ?mol-1;
(5)n(CaCO3)=
| 25g |
| 100g/mol |
Ca(OH)2+CO2=CaCO3+H2O
1 1
0.25mol 0.25mol
即甲烷燃烧生成的二氧化碳为0.25mol.
CH4 +2O2 =CO2+2H2O
0.25mol 0.25mol
即0.25mol甲烷放出的热量为Q,所以1mol甲烷放出的热量为4Q,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-4QkJ?mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-4QkJ?mol-1;
(6)在反应CH4(g)+4F2(g)=CF4(g)+4HF(g)中,△H=436kJ/mol+243kJ/mol-431kJ/mol×2-183kJ?mol-1,热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183kJ?mol-1,该反应放热,氢气与氯气的总能量大于氯化氢的总能量,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ?mol-1;大于.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目