题目内容
常温下,两种溶液① 0.1 mol?L-1 NH3·H2O ② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是: (用电离方程式表示)。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以 (填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是 (填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
(1)>(1分) NH3·H2O  NH4+ +OH- (2分)
NH4+ +OH- (2分)
(2)酸(1分) 促进(1分)
(3)b (1分)
解析试题解析:(1)NH3·H2O是弱碱,其在水中部分电离产生NH4+、OH-,所以pH>7,
(2)NH4Cl溶液中的NH4+水解会使溶液呈酸性,pH<7,水解反应是吸热反应,升温使平衡向吸热反应方向进行,因此会促进NH4Cl的水解。
(3)a、NH3·H2O是弱碱,不完全电离;NH4Cl溶液中NH4+部分水解,所以两种溶液NH4+的浓度均小于0.1mol/l,错误;b、正确;c、两种溶液中NH4+的浓度的大小由电离程度和水解程度的强弱来判断,本题中无法判断,答案选b。
考点:考查溶液的酸碱性、弱电解质的电离、盐的水解、外界条件对平衡的影响

甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g)+ 3H2(g)  CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L。
在1.0 L密闭容器中放入0.10 mol A (g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p /100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________________________________________________________________________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算a=__________________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
T ℃、2 L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。回答下列问题。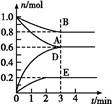
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
| 物质 | A | B | D | E |
| 物质的量(mol) | 0.8 | 1.0 | 0.4 | 0.2 |
此时v(正) v(逆)(填“大于”、“等于”或“小于”)。
25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。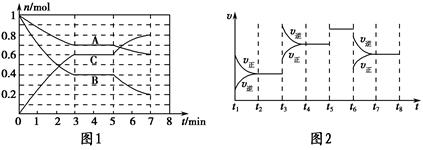
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
将水煤气转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 。
②下列能增大碳的转化率的措施是 。
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 CO(g)+2H2O(g) ΔH="-519" kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g)+2H2O(g) ΔH="-519" kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”、“Y”或“Z”),选择的理由是 。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g)  CO(g)+3H2 (g)……I CO(g)+2H2(g)
CO(g)+3H2 (g)……I CO(g)+2H2(g)  CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。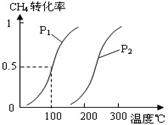
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________ 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H ____ 0;若容器容积不变,下列措施可增加甲醇产率的是________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | N(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应II的特点,在给出的坐标图中,画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
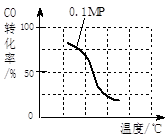
 CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。 W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。 。
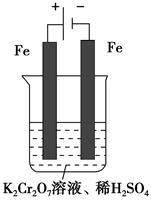
。 Cr2O72—(橙色)+H2O。
Cr2O72—(橙色)+H2O。