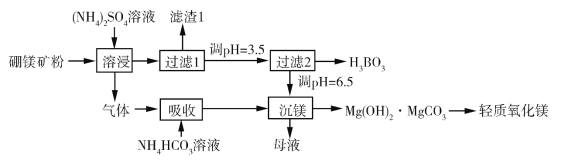
题目内容
【题目】T ℃,分别向10 mL浓度均为1 mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度对数(lgc)的关系如图所示。
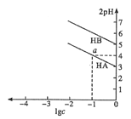
已知:pKa = -lgKa。
下列叙述正确的是
A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA) = 0.1 mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa≈5
【答案】D
【解析】
A.Ka不会随着溶液浓度的降低而变化,只受外界温度的影响,故A错误;B.a点2pH=4,即pH=2,lgc=-1,即c=0.1mol/L时c(H+)=0.01mol/L,所以对应的溶液中:c(HA)=0.1mol/L,c(H+)=0.01mol/L,pH=-lgc(H+)=2,故B错误;C.根据溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系图,得到HA酸中,2pH=4,即pH=2,lgc=-1,即c=0.1mol/L时c(H+)=0.01mol/L,对HB酸,c=0.1mol/L时,pH大于2,所以酸性:HA>HB,故C错误;D.根据图像,T℃时,弱酸HB的pKa=-lgKa,Ka=![]() ≈
≈![]() =10-5,pKa≈5,故D正确;故选D。
=10-5,pKa≈5,故D正确;故选D。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
【题目】下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
序号 | A | B | C | D |
实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
选用仪器 |
|
|
|
|
A. A B. B C. C D. D