��Ŀ����
����Ŀ����ͼװ�ã���֪���缫�Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��a����Cu2����2e���� Cu b����Fe��2e���� Fe2����ش��������⣺

��1����װ���е������Һһ������_______ ������ţ�
A�� Cu2�� B��Na�� C��Fe2�� D�� Ag��
��2������װ����ԭ��أ���b��Ϊ_______ �����������������a���ĵ缫���Ͽ�����________���õ�ط�Ӧ���ܷ�Ӧ����ʽ��____________________��
����װ���ǵ��أ���a��Ϊ______ ������������������� ��a������������6.4gʱ����·��ͨ�����ӵ����ʵ���Ϊ________ mol��
���𰸡�A �� ���������ü�����ͭ����������ʯī�� Fe��Cu2����Fe2����Cu �� 0.2
��������
���缫�Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��a����Cu2����2e���� Cu ��a��������ԭ��Ӧ��b����Fe��2e���� Fe2����b������������Ӧ���ܷ�ӦΪCu2����Fe= Cu+ Fe2��������a���缫��Ӧʽ�����·��ͨ�����ӵ����ʵ�����
��1��a��������ӦΪCu2����2e���� Cu��������Һ��һ����Cu2������ѡA����2��a����Cu2����2e���� Cu ��a��������ԭ��Ӧ��b����Fe��2e���� Fe2����b������������Ӧ��ԭ�������������ԭ��Ӧ����������������Ӧ������װ����ԭ��أ���b��Ϊ������a��Ϊ�����������ĵ缫���Ͽ����DZ��������ü�����ͭ����������ʯī�ȣ�������Ӧ+������Ӧ���ܷ�Ӧ�����Ըõ�ط�Ӧ���ܷ�Ӧ����ʽ��Fe��Cu2����Fe2����Cu����������������������Ӧ������������ԭ��Ӧ������װ���ǵ��أ���a��Ϊ��������a������6.4gͭ�����ݵ缫��ӦCu2����2e���� Cu��ת�Ƶ������ʵ�����0.2mol��

 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д�����Ŀ�������������ѧ���û�ѧ�Լ�����ҵ�ϳ������̿���Ҫ�ɷ���MnO2��Ϊԭ�Ͻ����Ʊ�����Ҫ������������ͼ��
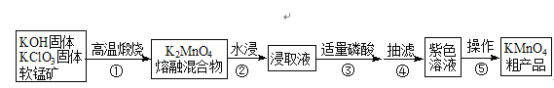
��֪��3K2MnO4+2H3PO4�T2KMnO4+MnO2��+2K2HPO4+2H2O
���� | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K�ܽ��/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
��1��ԭ�ϸ�������ʱѡ����������������������__________��
��2������ÿ����1molK2MnO4ʱ����ת��2mol��д����ѧ��Ӧ����ʽ_________��
��3���ӷ�Ӧ�����Ͳ������Ƕȿ��ǣ��ۿ������ᣬҲ��������________�Լ���
A������ B������ C������ D��CO2
��4��������������ȷ����_________��
A��������������������������������ȴ���壬���ȹ���
B������ʱ����©����ѡ�ô�С��С��©���ھ��Ҹ�סȫ��С����ֽ
C��������ˮ�Ҵ�ϴ�Ӳ�Ʒ��ߴ���
D��KMnO4����ĺ���¶ȹ��ή�Ͳ���
��5���ֲ�Ʒ��ϴ�Ӳ��������Ҫ�õ����²�����a������ϴ�Ӽ�����û���壻b��ϴ�Ӽ�����ͨ����c��ϴ�Ӽ�����ͨ����d����Сˮ��ͷ��e������ˮ��ͷ��f���ظ�2��3�Ρ�
��ѡ����ȷ�IJ���������________�����������ظ�ʹ�ã�
��6��������ز�Ʒ�Ĵ��Ȳⶨ��ȷ��ȡ0.7900g��Ʒ�����250mL��Һ����ȡ25.00mL����ƿ�У���0.1000molL��1��NH4��2Fe��SO4��2����Һ���еζ����ζ��յ������__________���ζ�ǰ�͵ζ����Һ�����ͼ�������������صĴ���Ϊ_______��

����Ŀ�������̿�(��Ҫ�ɷ�ΪMnO2)�����̿�(��Ҫ�ɷ�ΪMnS)Ϊԭ���Ʊ������̾���Ĺ����������£�

(1)�����д���һ�ַǽ������ʣ�����������еĻ�ѧ����ʽΪ_________________________________��
(2)ʵ���ҳ���������ԭ���ⶨMnSO4��H2O����Ĵ��ȣ�ԭ�����£�2Mn2����NO3-��4PO43-��2H��===2[Mn(PO4)2]3����NO2-��H2O NH4+��NO2-===N2����2H2O [Mn(PO4)2]3����Fe2��===Mn2����[Fe(PO4)2]3������ȡMnSO4��H2O��Ʒ1.000 0 g����������ˮ������������λ���������������泥���220��240 ���³�ַ�Ӧ��Ȼ����N�������ڰ�����������ָʾ������0.100 0 mol��L��1��������隣���Һ�ζ����ɵ�[Mn(PO4)2]3�����յ㡣�ظ�����3�Σ���¼�������±���
�ζ����� | ��Һ����mL | |
�ζ�ǰ | �ζ��� | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
����֪��Fe2����NO2-��2H��===Fe3����NO����H2O��
�ⶨ�����У�����淋�������____________________��____________________��
�����ζ������б���Һ��������鱗��������õģ����ⶨ��MnSO4��H2O����Ĵ��Ƚ���________(����ƫ������ƫ��������������)��
�ۼ�����Ʒ��MnSO4��H2O����������(д���������)__________________��






