题目内容
【题目】关于下列转化过程分析不正确的是( )
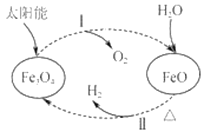
A.Fe3O4中Fe元素的化合价为+2、+3
B.过程Ⅰ中每消耗58gFe3O4转移1mol电子
C.过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为2H2O=2H2↑+O2↑
【答案】B
【解析】
A.Fe3O4的化学式可以改写为FeO·Fe2O3,则Fe3O4中Fe元素的化合价为+2、+3,故A正确;
B.过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g),当有2molFe3O4分解时,生成1mol氧气,而58g Fe3O4的物质的量为0.25mol,故生成0.125mol氧气,而氧元素由-2价变为0价,故转移0.5mol电子,故B错误;
C.过程Ⅱ中FeO与水反应生成四氧化三铁和氢气,反应化学方程式为3FeO+H2O![]() Fe3O4+H2↑,故C正确;
Fe3O4+H2↑,故C正确;
D.过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g),过程II:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s),因此该过程总反应为2H2O=O2↑+2H2↑,故D正确;
故选:B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目