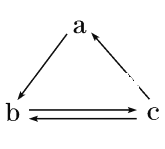
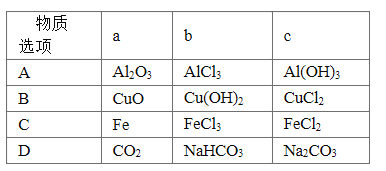
题目内容
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。按下图装置进行实验。并回答以下问题。
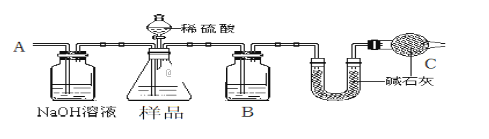
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为___________________,C装置的作用是___________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________________。
(3)该样品中NaHCO3的质量分数为_______________________(保留三位有效数字)。
(4)现有等物质的量浓度的NaHCO3溶液和Na2CO3溶液各一瓶,请选择正确的方法进行鉴别____。
A.加热法:产生使澄清石灰水变浑浊气体的是NaHCO3
B.沉淀法:加入BaCl2溶液,产生沉淀的是Na2CO3溶液
C.气体法:逐滴加入盐酸,立即产生气泡的是NaHCO3溶液
D.测pH法:用pH试纸测其pH,pH大的是Na2CO3溶液
【答案】 浓H2SO4 防止空气中水蒸气、CO2进入U型管被吸收 把反应产生的CO2全部导入U形管中 70.4% BCD
【解析】由实验装置可知,从导管A处缓缓鼓入一定量的空气,先将装置中的二氧化碳排出,NaOH溶液可除去空气中的二氧化碳,锥形瓶中发生样品与硫酸的反应生成二氧化碳气体,B中应为浓硫酸干燥二氧化碳,U型管增重为反应生成二氧化碳的质量,干燥管中的碱石灰防止空气中的水蒸气、二氧化碳进入U型管中干扰含量的测定,则
(1)由上述分析可知B瓶中装的试剂为浓硫酸,C装置的作用是防止空气中水蒸气、CO2进入U型管被吸收;(2)导管A处缓缓鼓入一定量的空气的目的是把反应产生的CO2全部导入U形管中;(3)设NaHCO3和Na2CO3的质量分别为xg、yg,则x+y=17.90、x/84+y/106=8.8/44,两式联立解得x=12.6,因此该样品中NaHCO3的质量分数为12.60/17.90×100%=70.4%;A.加热法一般适用于鉴别碳酸钠和碳酸氢钠固体,A错误;B.加入BaCl2溶液,产生沉淀的是Na2CO3溶液,碳酸氢钠与氯化钡不反应,B正确;C.碳酸钠与盐酸反应分步进行,因此逐滴加入盐酸,立即产生气泡的是NaHCO3溶液,C正确;D.碳酸根的水解程度大于碳酸氢根,所以浓度相等时碳酸钠溶液的碱性强于碳酸氢钠,pH大,D正确,答案选BCD。

 提分百分百检测卷系列答案
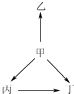
提分百分百检测卷系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | SiO2 | SiF4 | H2SiO3 | Na2SiO3 |
D | Al | AlCl3 | Al2O3 | NaAlO2 |
A.A
B.B
C.C
D.D