题目内容
1.某有机物具有下列性质:能发生银镜反应;滴人紫色石蕊试液不变色;加入少量碱液并滴入酚酞试液,共煮后红色消失.原有机物可能是( )| A. | 甲酸 | B. | 甲醇 | C. | 乙酸甲酯 | D. | 甲酸乙酯 |
分析 能发生银镜反应说明含有醛基,滴入紫色石蕊试液不变色,说明不含羧基;滴入少量碱液并滴入酚酞试液共煮后,红色消失,则该物质水解生成羧酸钠,说明含有酯基,据此分析解答.
解答 解:能发生银镜反应说明含有醛基,滴入紫色石蕊试液不变色,说明不含羧基;滴入少量碱液并滴入酚酞试液共煮后,红色消失,则该物质水解生成羧酸钠,说明含有酯基,
A.甲酸中含有醛基和羧基,能发生银镜反应也能使紫色石蕊试液变色,不符合条件,故A错误;
B.甲醇中不含醛基,所以不能发生银镜反应,不符合条件,故B错误;
C.乙酸甲酯中不含醛基,所以不能发生银镜反应,不符合条件,故C错误;
D.甲酸乙酯中含有醛基,能发生银镜反应,不含羧基,所以不能使紫色石蕊试液变色,含有酯基能水解,所以符合条件,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意能发生银镜反应的不一定是醛,可能是甲酸或甲酸某酯,为易错点.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
11.下列关于实验操作或结论的叙述错误的是( )
| A. | 牙膏中含有甘油,起到保湿作用;添加的二氧化硅则用于增强牙膏的摩擦作用和去污效果 | |
| B. | 减压过滤可加快过滤速度并得到较干燥的沉淀,可用于胶状沉淀的分离 | |
| C. | 阿司匹林粗产品中往往含有少量聚合物而不能服用,可用饱和碳酸氢钠溶液提纯阿司匹林 | |
| D. | 可用纸层析法分离含少量Fe3+和Cu2+的混合溶液,亲水性强的Cu2+在滤纸条的下方 |
9.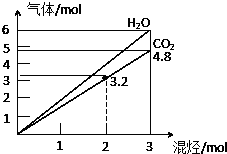 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
( )
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C4H6
⑤可能有C2H6.
 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C4H6
⑤可能有C2H6.
| A. | ②⑤ | B. | ②④ | C. | ③④ | D. | ②③ |
16.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应当n(NaHCO3):n[Ca(OH)2]=2:1时HCO3-完全转化为CaCO3 | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时,铝元素以AlO2-形式存在 | |
| D. | Cl2通入含2mol FeI2的溶液中,当n(Fe2+):n(I2)=1:1时,通入的Cl2为2mol |
6.下列性质中,仅属于烷烃特征的是( )
| A. | 完全燃烧产物只有二氧化碳和水 | |
| B. | 它们几乎不溶于水 | |
| C. | 分子的通式为CnH2n+2,与氯气发生取代反应 | |
| D. | 它们完全由碳氢元素组成 |
13.某羧酸衍生物A,其分子式为C6H12O2,实验表明A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化和加热的条件下氧化为E,其中D、E都不能发生银镜反应.由此判断A的可能的结构有( )
| A. | 6种 | B. | 4种 | C. | 2种 | D. | 1种 |
10.同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性X<Y<Z | |
| C. | 元素的负化合价的绝对值按X、Y、Z减小 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序减弱 |
18.根据等电子原理,互为等电子体的微粒具有相似的空间构型.下列各组粒子的空间构型不同的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |