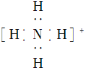题目内容
【题目】化学与生产生活关系密切。下列有关说法错误的是( )
A.港珠澳大桥使用的超高分子量聚乙烯纤维属于有机高分子化合物
B.质谱法是测定有机物相对分子质量及确定化学式的分析方法之一
C.“玉兔二号”月球车使用的帆板太阳能电池的材料是![]()
D.宋·王希孟《千里江山图》卷中绿色颜料“铜绿”的主要成分是碱式碳酸铜
【答案】C
【解析】
A.聚乙烯纤维的相对分子质量在10000以上,为合成高分子化合物,故A正确;
B.质谱法是纯物质鉴定的最有力工具之一,其中包括相对分子量测定、化学式的确定及结构鉴定等,故B正确;
C.硅为良好的半导体材料,能制造太阳能电池板,所以“玉兔号”月球车上的太阳能电池的材料是硅,故C错误;
D.铜绿的主要成分是碱式碳酸铜,则绿色颜料铜绿的主要成分是碱式碳酸铜,故D正确;
答案选C。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
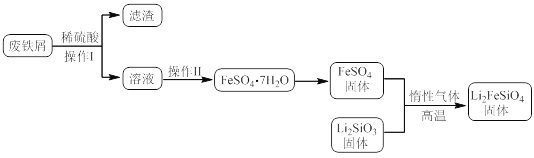
实验(二)Li2FeSiO4含量测定:
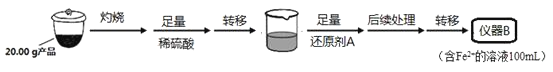
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B__,仪器C__。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是__。
(3)操作Ⅱ的步骤__,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需__。
(4)还原剂A可用SO2,写出该反应的离子方程式__,此时后续处理的主要目的是__。
(5)滴定终点时现象为__;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为_。
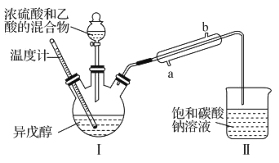
【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯
【题目】某小组探究![]() 溶液和
溶液和![]() 溶液的反应原理。
溶液的反应原理。
(实验一)将含淀粉的![]() 溶液加入
溶液加入![]() 酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
(1)溶液变蓝,说明![]() 具有__________性。
具有__________性。
(2)查阅文献:
反应Ⅰ:![]() 慢
慢
反应Ⅱ:![]() _____=_____+_____ 较快
_____=_____+_____ 较快
反应Ⅲ:![]() 快
快
写出酸性条件下,反应Ⅱ的离子方程式__________。
(3)向实验一所得蓝色溶液中加入少量![]() 溶液,蓝色迅速褪去,后又变蓝色。据此得出
溶液,蓝色迅速褪去,后又变蓝色。据此得出![]() 氧化性比
氧化性比![]() 强,该结论______(填“合理”或“不合理”),理由是_________。
强,该结论______(填“合理”或“不合理”),理由是_________。
(4)为了进一步研究![]() 溶液和
溶液和![]() 溶液的反应原理,设计如下实验。
溶液的反应原理,设计如下实验。
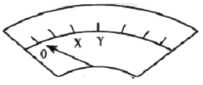
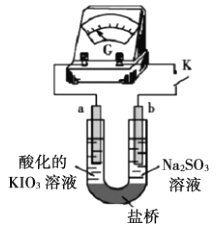
(实验二)装置如图所示,![]() 闭合后,电流表的指针偏转情况记录如表:
闭合后,电流表的指针偏转情况记录如表:
表盘 |
|
| ||
时间/min |
|
|
| |
偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
①![]() 闭合后,检验b极附近溶液存在放电产物
闭合后,检验b极附近溶液存在放电产物![]() 的实验操作是__________。
的实验操作是__________。
②![]() 时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断
时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断![]() 在a极放电的产物是__________。
在a极放电的产物是__________。
(5)下列关于上述实验解释合理的是__________(填字母序号)。
A.实验一中:5秒内无明显变化,可能是因为反应Ⅰ的活化能太小,反应速率太慢
B.实验二中:指针回到“0”处,可能是因为反应Ⅱ比反应Ⅰ快,导致![]() 难与
难与![]() 发生反应
发生反应
C.实验二中:又返至“X”处,可能是因为发生了反应Ⅲ,重新形成了原电池