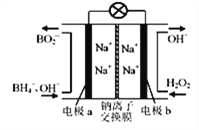
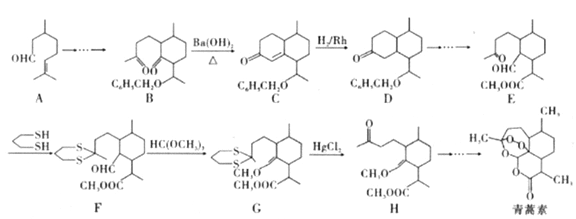
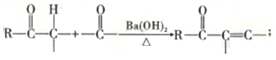
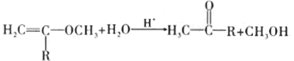
题目内容
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。

已知:
① 2NO+Na2O2=2NaNO2。
② NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③ 在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-。
④ 在此条件下,Na2O2完全反应,无剩余。
【制备NaNO2】
(1) 装置A的三颈烧瓶中发生反应的化学方程式为_____________。
(2) 装置B中水和铜的作用分别是__________、__________。
(3) 为了保证制得亚硝酸钠的纯度,装置C中盛放的试剂可能是_________(填字母)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.NaCl
(4) 装置E的作用是_______________。
【测定NaNO2纯度】
(5) 可供选择的试剂有:
A.稀硫酸 b.c1mol/LKI溶液 C.淀粉溶液 D.c2mol/LNa2S2O3溶液 e.c3 mol/L酸性KMnO4溶液
① 利用NaNO2的还原性来测定其纯度,可选择的试剂是________(填字母)。
② 利用NaNO2的氧化性来测定其纯度的步骤如下:
准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,_________(请补充完整实验步骤)。
【答案】(l)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)将NO2转化为NO;铜与稀硝酸反应生成NO
(3)B
(4)吸收有毒的NO气体,防止污染空气
(5)①e②加人过量c1mol/LKI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol/LNa2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操 作2~3次
【解析】
试题分析:(1)在装置A三颈烧瓶中浓硝酸与C在加热时发生氧化还原反应,化学方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;(2)NO2溶于水,与水发生反应产生NO, 3NO2+ H2O == 2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。所以 B装置的作用是将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3) CO2是酸性氧化物,可以与碱性发生反应,可以除去NO中的CO2气体的试剂是碱石灰;(4)NO能被酸性KMnO4氧化成NO3-,E可吸收有毒的NO气体,防止污染空气;(5)① 高锰酸钾溶液具有氧化性,利用NaNO2的还原性来测定其纯度,可选择的试剂是c3 mol/L酸性KMnO4溶液;②在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-,利用NaNO2的氧化性来测定其纯度,可选择的试剂是具有还原性的c1mol/LKI溶液、稀硫酸 即作指示剂的淀粉溶液,步骤是:准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,加人过量c1mol/LKI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol/LNa2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操 作2~3次。
CO2↑+4NO2↑+2H2O;(2)NO2溶于水,与水发生反应产生NO, 3NO2+ H2O == 2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。所以 B装置的作用是将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3) CO2是酸性氧化物,可以与碱性发生反应,可以除去NO中的CO2气体的试剂是碱石灰;(4)NO能被酸性KMnO4氧化成NO3-,E可吸收有毒的NO气体,防止污染空气;(5)① 高锰酸钾溶液具有氧化性,利用NaNO2的还原性来测定其纯度,可选择的试剂是c3 mol/L酸性KMnO4溶液;②在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-,利用NaNO2的氧化性来测定其纯度,可选择的试剂是具有还原性的c1mol/LKI溶液、稀硫酸 即作指示剂的淀粉溶液,步骤是:准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,加人过量c1mol/LKI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol/LNa2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操 作2~3次。

【题目】已知:
化学键 | C—H | C—F | H—F | F—F |
键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=akJ·mol-1。则a等于
A. -1928 B. +1928 C. +1838 D. -1838