题目内容
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为 ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
I.(1)有气泡产生,溶液变成(血)红色(2分)(只要给出溶液变成(血)红色即得分)
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Fe3++3SCN-= Fe(SCN)3(写成可逆符号给分)(2分)
(2)Fe2O3、CuO(2分)(漏写一种得一分,有错写不给分)(其他合理答案也可)
(3)56(2分)
Ⅱ. (2分)
(2分)
Ⅲ. N2(g) + O2(g)=2NO(g) △H3 =" b" kJ/mol (2分) a - 2b(2分)
或2NO(g)=N2(g) + O2(g) △H3 =" b" kJ/mol a +2b
解析试题分析:依题意可以推出溶液中含有的离子种类应有Fe2+,NO3-,Cu2+ ,SO42-,Cl-。可以回答问题(1)。(2)应考虑Fe(OH)2在加热时生成Fe(OH)3,Cu(OH)2和Fe(OH)3在灼烧时生成Fe2O3、CuO。(3)因为4NO + 3O2 + 2H2O = 4HNO3,利用Fe2+的量为0.01mol,可以算出O2的体积。Ⅱ利用电子得失守恒可以推出被氧化的硝酸为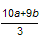 ,用硝酸的总量减去被氧化的硝酸可以求出。Ⅲ可以利用盖斯定律,欲计算反应CH4(g)+4NO(g)
,用硝酸的总量减去被氧化的硝酸可以求出。Ⅲ可以利用盖斯定律,欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l),我们还需要知道N2与NO的关系。带入N2(g) + O2(g)=2NO(g) △H3 =" b" kJ/mol,△H2=△H1-2△H3
2N2(g)+CO2(g)+2H2O(l),我们还需要知道N2与NO的关系。带入N2(g) + O2(g)=2NO(g) △H3 =" b" kJ/mol,△H2=△H1-2△H3
考点:利用离子的电荷守恒进行推断,并考察物质间反应时的电子转移和化学方程式及热化学方程式的书写。

部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 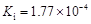 |  | 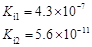 | 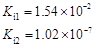 |
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:HI+ H6TeO6
 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O(6)若反应中生成的TeO2与Te的物质的量之比为
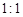 ,试配平上述化学方程式。
,试配平上述化学方程式。 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为 mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为 、 。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |

①上述生产过程的能量转化方式是
②上述电解反应在温度小于900 0C时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 MnO4-+
MnO4-+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ O2+
O2+
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。
如何判断滴定到达终点:
。
(4)如图表示25 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)________。
| A.是a mL | B.是(25-a)mL | C.一定大于a mL | D.一定大于(25-a)mL |
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。
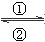 Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。 ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。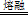 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O