题目内容
在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为p1.若控制容器的体积不变,加入足量的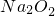 ,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为p2.则p1和p2之间的关系是
,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为p2.则p1和p2之间的关系是
- A.p1=8p2
- B.p1=4p2
- C.p1=2p2
- D.p1=p2
A
分析:2CO+O2 2CO2,2CO2+2Na2O2=2Na2CO3+O2,故当于发生反应:CO+Na2O2=Na2CO3,故CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2、CO+Na2O2=Na2CO3,根据混合气体是相同条件下氦气密度的8倍,计算混合气体中CO2和CO的物质的量之比,再根据反应前后的压强之比=反应前后的物质的量之比来计算.
2CO2,2CO2+2Na2O2=2Na2CO3+O2,故当于发生反应:CO+Na2O2=Na2CO3,故CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2、CO+Na2O2=Na2CO3,根据混合气体是相同条件下氦气密度的8倍,计算混合气体中CO2和CO的物质的量之比,再根据反应前后的压强之比=反应前后的物质的量之比来计算.
解答:CO2和CO的混合气体的密度是相同条件下氦气密度的8倍,则44n(CO2)+28n(CO)=32n(CO2)+32n(CO),
整理得n(CO2):n(CO)=1:3,
CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2、CO+Na2O2=Na2CO3,
令开始n(CO2)=1mol、n(CO)=3mol,则用电火花点燃至反应完全后,容器内n(O2)= n(CO2)=0.5mol,
n(CO2)=0.5mol,
反应前后的压强之比=反应前后的物质的量之比,故p1:p2=(1mol+3mol):0.5mol=8:1,即p1=8p2,
故选A.
点评:本题考查过氧化钠的化学性质、化学计算等,难度中等,根据发生的反应利用总方程式进行解答是关键,本题容易忽略一氧化碳与氧气反应生成二氧化碳,二氧化碳继续与过氧化钠反应,不能根据整体反应分析计算导致计算复杂化.
分析:2CO+O2
 2CO2,2CO2+2Na2O2=2Na2CO3+O2,故当于发生反应:CO+Na2O2=Na2CO3,故CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2、CO+Na2O2=Na2CO3,根据混合气体是相同条件下氦气密度的8倍,计算混合气体中CO2和CO的物质的量之比,再根据反应前后的压强之比=反应前后的物质的量之比来计算.
2CO2,2CO2+2Na2O2=2Na2CO3+O2,故当于发生反应:CO+Na2O2=Na2CO3,故CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2、CO+Na2O2=Na2CO3,根据混合气体是相同条件下氦气密度的8倍,计算混合气体中CO2和CO的物质的量之比,再根据反应前后的压强之比=反应前后的物质的量之比来计算.解答:CO2和CO的混合气体的密度是相同条件下氦气密度的8倍,则44n(CO2)+28n(CO)=32n(CO2)+32n(CO),
整理得n(CO2):n(CO)=1:3,
CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2、CO+Na2O2=Na2CO3,
令开始n(CO2)=1mol、n(CO)=3mol,则用电火花点燃至反应完全后,容器内n(O2)=
 n(CO2)=0.5mol,
n(CO2)=0.5mol,反应前后的压强之比=反应前后的物质的量之比,故p1:p2=(1mol+3mol):0.5mol=8:1,即p1=8p2,
故选A.
点评:本题考查过氧化钠的化学性质、化学计算等,难度中等,根据发生的反应利用总方程式进行解答是关键,本题容易忽略一氧化碳与氧气反应生成二氧化碳,二氧化碳继续与过氧化钠反应,不能根据整体反应分析计算导致计算复杂化.

练习册系列答案
相关题目