题目内容
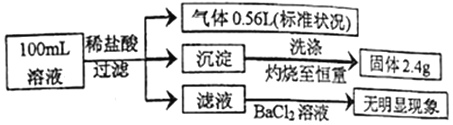
【题目】物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。
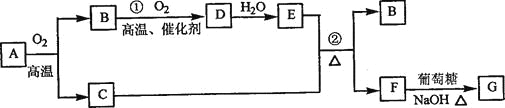
请回答下列问题:
(1)写出下列物质的化学式:B__________、E__________、G__________;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是____________,阴极物质是__________,电解质溶液是__________;
(3)反应②的化学方程式是__________。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K=___________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度___________(填“增大”、“不变”或“减小”),氧气的转化率___________(填“升高”、“不变”或“降低”),D的体积分数___________(填“增大”、“不变”或“减小”)。
【答案】SO2 H2SO4 Cu2O 粗铜 精铜 CuSO4溶液 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 23.8mol-1·L 减小 降低 减小
CuSO4+SO2↑+2H2O 23.8mol-1·L 减小 降低 减小
【解析】
砖红色沉淀G是葡萄糖和新制Cu(OH)2的反应,则G和单质C分别为Cu2O和Cu,结合反应①条件可确定B、D分别为SO2、SO3; E和F分别为H2SO4和CuSO4。
(1)由分析可知,B是SO2,E是H2SO4,G是Cu2O;
(2)电解精炼铜时,用粗铜做阳极,精铜做阴极,电解质溶液含有Cu2+,可以用CuSO4溶液;
(3)反应②是加热条件下铜和浓硫酸的反应,化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①为2SO2(g)+O2(g)![]() 2SO3(g),,在一定温度下,反应达到平衡,得到0.12 mol SO3,则消耗了0.12mol SO2 和0.06mol O2,剩余的SO2 和 O2分别为0.11mol和0.05mol,容器体积为1L,所以平衡时SO2(g)、O2(g)和SO3(g)的物质的量浓度分别为0.11mol/L、0.05mol/L和0.12mol/L,根据 K=
2SO3(g),,在一定温度下,反应达到平衡,得到0.12 mol SO3,则消耗了0.12mol SO2 和0.06mol O2,剩余的SO2 和 O2分别为0.11mol和0.05mol,容器体积为1L,所以平衡时SO2(g)、O2(g)和SO3(g)的物质的量浓度分别为0.11mol/L、0.05mol/L和0.12mol/L,根据 K= ,带入数据求得K=23.8mol-1·L。平衡后通入O2,可以提高SO2的转化率,但O2自身转化率减小。由于通入的氧气过多,远远多于化学计量数之比,虽然平衡正向移动,SO3的物质的量会增大,但由于混合气的总的物质的量增加得更多,所以再达到平衡时SO3的体积分数会减小。
,带入数据求得K=23.8mol-1·L。平衡后通入O2,可以提高SO2的转化率,但O2自身转化率减小。由于通入的氧气过多,远远多于化学计量数之比,虽然平衡正向移动,SO3的物质的量会增大,但由于混合气的总的物质的量增加得更多,所以再达到平衡时SO3的体积分数会减小。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案