题目内容
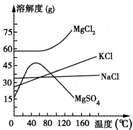
 海水中常含MgCl2、NaCl、MgSO4、KCl等,加工后可制得一些重要的产品.若将海水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分为甲;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到较纯净的晶体乙.下列关于甲、乙成分的推断正确的是( )
海水中常含MgCl2、NaCl、MgSO4、KCl等,加工后可制得一些重要的产品.若将海水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分为甲;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到较纯净的晶体乙.下列关于甲、乙成分的推断正确的是( )分析:加热时析出晶体,说明该晶体溶解度随温度的升高而降低;降温时析出晶体,说明该晶体溶解度随温度的降低而降低.
解答:解:观察溶解度图象,当温度大于60℃,随着温度的升高,MgSO4的溶解度反而下降,NaCl的溶解度一直比较低.所以这两种物质就会结晶析出,甲的主要成分为硫酸镁和氯化钠;
降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,MgCl2和KCl随着温度的降低而下降,将母液R降温(降到30℃以下)析出晶体B主要是MgCl2,KCl;
故选D.
降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,MgCl2和KCl随着温度的降低而下降,将母液R降温(降到30℃以下)析出晶体B主要是MgCl2,KCl;
故选D.
点评:本题考查溶解度、饱和溶液等,难度中等,学会分析溶解度图象的方法,并且理解升温或者降温时结晶析出的条件是解题的关键.

练习册系列答案
相关题目

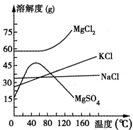 海水中常含MgCl2、NaCl、MgSO4、KCl等,加工后可制得一些重要的产品.若将海水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分为甲;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到较纯净的晶体乙.下列关于甲、乙成分的推断正确的是
海水中常含MgCl2、NaCl、MgSO4、KCl等,加工后可制得一些重要的产品.若将海水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分为甲;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到较纯净的晶体乙.下列关于甲、乙成分的推断正确的是