题目内容
【题目】化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物D.利用蒸馏法从海水中分离出淡水
【答案】D
【解析】
A.秸秆通过发酵生成乙醇,为化学变化,故A错误;
B.石油生产塑料、化纤,裂化生成小分子,小分子发生加聚反应生成高分子,为化学变化,故B错误;
C.基本的化学原料生产化学合成药物,发生化学反应生成新物质,为化学变化,故C错误;
D.利用蒸馏法从海水中分离出淡水,无新物质生成,是物理变化,故D正确;
故答案为D。

 轻松课堂标准练系列答案
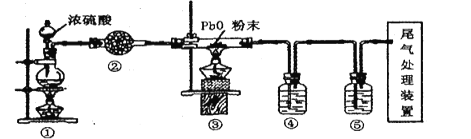
轻松课堂标准练系列答案【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
(实验)
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是_____________________________________。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.停止实验时,应先停止通入H2,后停止加热
(提出假设)
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设:
假设1:含有Ca和CaH2;
假设2:含有CaH2和CaO;
假设3:含有__________________。
(设计实验方案,验证假设)
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,____________________________________________________________________。 | _______________________________________________。 |
(4)定量实验测定Ca和CaH2混合物中CaH2的质量分数。
①取m1 g样品与水完全反应,利用如图装置测定生成的气体体积时,在________时进行收集(填字母)。
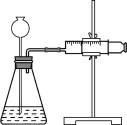
a.刚开始有气泡
b.气泡连续均匀
c.气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定_____________(填“偏高”“偏低”或“无影响”),则计算出氢化钙的质量分数_____________(填“偏高”“偏低”或“无影响”)。
(反思与交流)
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是_______________________________________________________________________________________________________________ 。
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆