题目内容
【题目】Ⅰ.某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________。
(2)反应开始至2 min,用Y表示的平均反应速率为__________mol/L·min,X的转化率为_________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是________。
A.X、Y、Z的浓度相等
B.X、Y、Z的分子数比为3︰1︰2
C.Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
Ⅱ.根据如下图的原电池装置,完成下列内容
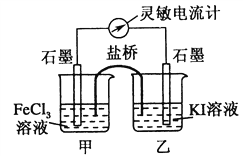
(4)该装置左池为________极,电极反应式为_____________。
(5)过一段时间后往右池中滴加淀粉溶液,现象是______________。
【答案】 3X+Y![]() 2Z 0.025 30% C 正 Fe3++e—=Fe2+ 溶液变蓝
2Z 0.025 30% C 正 Fe3++e—=Fe2+ 溶液变蓝
【解析】I.本题考查化学反应速率的计算和化学平衡状态的判断,(1)X和Y物质的量减少,即为反应物,Z的物质的量增大,即为生成物,同一容器中,化学反应速率之比等于物质的量变化之比,等于化学计量数之比,即X、Y、Z的化学计量数之比为(1-0.7):(1-0.9):0.2=3:1:2,反应方程式为3X+Y![]() 2Z;(2)根据化学反应速率的数学表达式,v(Y)=0.1/(2×2)mol/(L·min)=0.025 mol/(L·min);X的转化率为(1-0.7)/1×100%=30%;(3)A、根据化学平衡状态的定义,是组分的浓度不变,而不是组分的浓度相等,因此不能说明达到平衡,故A错误;B、题目中没有说明开始通入组分的量,因此不能判断是否达到平衡,故B错误;C、用不同物质的化学反应速率表示达到平衡,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成Z说明反应向正反应方向进行,生成Y说明反应向逆反应方向进行,生成Z的速率是生成Y速率的二倍,说明速率之比等于化学计量数之比,因此能说明反应达到平衡,故C正确;D、根据选项C的分析,此反应都是向逆反应方向进行,不能说明达到平衡,故D错误;II.本题考查原电池的工作原理,(4)根据原电池的工作原理,正极上得到电子,化合价降低,发生还原反应,负极上失去电子,化合价升高,发生氧化反应,电池总反应是2Fe3++2I-=2Fe2++I2,因此装置的左池为正极,电极反应式为Fe3++e-=Fe2+;(5)装置右池反应式为2I--2e-=I2,滴加淀粉溶液,溶液变蓝。
2Z;(2)根据化学反应速率的数学表达式,v(Y)=0.1/(2×2)mol/(L·min)=0.025 mol/(L·min);X的转化率为(1-0.7)/1×100%=30%;(3)A、根据化学平衡状态的定义,是组分的浓度不变,而不是组分的浓度相等,因此不能说明达到平衡,故A错误;B、题目中没有说明开始通入组分的量,因此不能判断是否达到平衡,故B错误;C、用不同物质的化学反应速率表示达到平衡,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成Z说明反应向正反应方向进行,生成Y说明反应向逆反应方向进行,生成Z的速率是生成Y速率的二倍,说明速率之比等于化学计量数之比,因此能说明反应达到平衡,故C正确;D、根据选项C的分析,此反应都是向逆反应方向进行,不能说明达到平衡,故D错误;II.本题考查原电池的工作原理,(4)根据原电池的工作原理,正极上得到电子,化合价降低,发生还原反应,负极上失去电子,化合价升高,发生氧化反应,电池总反应是2Fe3++2I-=2Fe2++I2,因此装置的左池为正极,电极反应式为Fe3++e-=Fe2+;(5)装置右池反应式为2I--2e-=I2,滴加淀粉溶液,溶液变蓝。

 阅读快车系列答案
阅读快车系列答案【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是
HCN | S8 | |
结构模型示意图 |
|
|
备注 | - | 易溶于CS2 |
SF6 | B12结构单元 | |
结构模型示意图 |
|
|
备注 | - | 熔点1873K |
A. HCN的结构式为H—C≡N
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键,含20个正三角形