题目内容
(8分)海水中溴常以NaBr形式存在,从海水中提取溴的方法之一是:①通入Cl2至浓缩的溴化物溶液,氧化海水中的Br-,然后用空气把生成的溴吹出。②以氢氧化钠溶液吸收Br2(Br2跟烧碱生成NaBr和NaBrO3)。③向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。完成下列问题:
(1)写出各步反应的化学方程式。(提示:第③步反应中生成物有硫酸钠)
(2)经分析海水中含溴0.006 5%,则海水中含NaBr的质量分数是多少?试计算多少吨海水可制得1.0 t溴?(假设提取过程中溴无损失)
(1)写出各步反应的化学方程式。(提示:第③步反应中生成物有硫酸钠)
(2)经分析海水中含溴0.006 5%,则海水中含NaBr的质量分数是多少?试计算多少吨海水可制得1.0 t溴?(假设提取过程中溴无损失)
(1)2NaBr+Cl2====2NaCl+Br2;6NaOH+3Br2====5NaBr+NaBrO3+3H2O;5NaBr+NaBrO3 +3H2SO4====3Na2SO4+3Br2+3H2O
(2)0.008 4% 需海水的质量为15 384.6 t
因海水中含溴0.006 5%,则海水中含NaBr的质量分数为0.006 5%×(103/80)="0.008" 4%;设需x t海水,则:0.006 5%x t="1" t,解得:x="15" 384.6 t。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
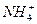 +Cl-,NH4Cl属于盐
+Cl-,NH4Cl属于盐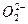 ====O2↑+4OH-
====O2↑+4OH- ====3BaSO4↓+2Al(OH)3↓
====3BaSO4↓+2Al(OH)3↓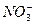 ====Cu2++2NO↑+H2O
====Cu2++2NO↑+H2O