题目内容
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如下图所示,则溶液中c(Cl)与c(SO42)之比为( )
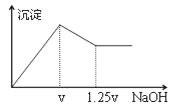
A.1∶1 B.2∶3 C.3∶2 D.2∶1
【答案】B
【解析】
试题分析:设氢氧化钠物质的量浓度为1mol/L,首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol-0.75molV=0.25Vmol,则n(Mg2+)=0.125Vmol,n(Cl-)=0.25Vmol;n(Al3+)=0.25Vmol,n(SO42-)=![]() n(Al3+)=
n(Al3+)=![]() ×0.25Vmol,溶液中c(Cl-):c(SO42-)=n(Cl-):n(SO42-)=0.25Vmol:
×0.25Vmol,溶液中c(Cl-):c(SO42-)=n(Cl-):n(SO42-)=0.25Vmol:![]() ×0.25Vmol=2:3,故选B。
×0.25Vmol=2:3,故选B。

练习册系列答案
相关题目