题目内容
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=______________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2 和p3 由大到小的顺序是______________________________,其原因是__________________________________________________________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_____________________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O![]() )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________。
②NO吸收转化后的主要产物为NH![]() ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
【答案】高温 +247.1 p1>p2>p3 温度相同时,增大压强,化学平衡向正反应方向移动,故平衡混合物中氨的体积分数越大则对应压强越大 < 8.3×103 2SO32-+4H++2e-===S2O42-+2H2O 1 344 ![]()
【解析】
(1)根据![]() 判断反应①自发进行的条件;根据盖斯定律计算ΔH3;
判断反应①自发进行的条件;根据盖斯定律计算ΔH3;
(2) ①增大压强N2 (g)+3H2 (g) ![]() 2NH3(g)平衡正向移动,氨的体积分数增大;
2NH3(g)平衡正向移动,氨的体积分数增大;
②压强越大、温度越高,反应速率越快;
③利用“三段式”计算在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器各物质的量;
(3)①阴极SO32-得电子发生还原反应生成S2O42-;
②根据得失电子守恒计算吸收NO的体积;
Ⅳ、醋酸电离平衡常数Ka=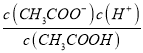 。
。
(1)该反应ΔH>0、ΔS>0, ![]() 能自发进行,所以在高温条件下反应①能自发进行;
能自发进行,所以在高温条件下反应①能自发进行;
CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
根据盖斯定律①-②得CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3=ΔH1-ΔH2=+205.9 kJ·mol-1+41.2 kJ·mol-1=+247.1 kJ·mol-1;
2CO(g)+2H2(g) ΔH3=ΔH1-ΔH2=+205.9 kJ·mol-1+41.2 kJ·mol-1=+247.1 kJ·mol-1;
(2) ①温度相同时,增大压强,N2 (g)+3H2 (g) ![]() 2NH3(g)平衡正向移动,所以压强越大氨的体积分数增大,p1、p2 和p3 由大到小的顺序是p1>p2>p3;
2NH3(g)平衡正向移动,所以压强越大氨的体积分数增大,p1、p2 和p3 由大到小的顺序是p1>p2>p3;
②压强越大、温度越高,反应速率越快;A点压强、温度都低于B,所以vA(N2) <vB(N2);
③
N2 (g)+3H2 (g) ![]() 2NH3(g)
2NH3(g)
开始 0.1 0.3 0
转化 x 3x 2x
平衡 0.1-x 0.3-3x 2x
![]()
x=0.08mol
平衡时N2 、H2 、NH3的物质的量分别是0.02、0.06、0.16;N2 的分压p(N2)为![]() 8.3×103;
8.3×103;
(3)①阴极SO32-得电子发生还原反应生成S2O42-,阴极反应式是2SO32-+4H++2e-===S2O42-+2H2O;
②NO吸收转化后的主要产物为NH![]() ,吸收1molNO转移5mol电子,设吸收标准状况下NO的体积为xL
,吸收1molNO转移5mol电子,设吸收标准状况下NO的体积为xL
![]()
span>X=1.344L=1344mL;
Ⅳ、将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,根据物料守恒c(Ba2+)=![]() ,c(CH3COO-)+ c(CH3COOH) =
,c(CH3COO-)+ c(CH3COOH) =![]() ,2c(Ba2+)=c(CH3COO-),则c(CH3COO-)=b,c(CH3COOH) =
,2c(Ba2+)=c(CH3COO-),则c(CH3COO-)=b,c(CH3COOH) =![]() ,根据电荷守恒和2c(Ba2+)=c(CH3COO-)可知c(H+)= c(OH-)=10-7,Ka=
,根据电荷守恒和2c(Ba2+)=c(CH3COO-)可知c(H+)= c(OH-)=10-7,Ka=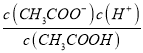 =
=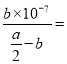
![]() 。
。

 备战中考寒假系列答案
备战中考寒假系列答案









