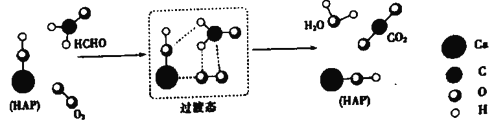
题目内容
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_____________________。
(3)YX4M的电子式为___________________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为___________________________________。
(4)X、Z两元素形成的原子个数比为1∶1的化合物的结构式____________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_________________。
【答案】第三周期ⅠA族 Cl->O2->Mg2+ ![]() Mg3N2+6H2O=3Mg(OH)2+2NH3↑ H-O-O-H Cl2+2OH-=ClO-+Cl-+H2O
Mg3N2+6H2O=3Mg(OH)2+2NH3↑ H-O-O-H Cl2+2OH-=ClO-+Cl-+H2O
【解析】
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大.X是原子半径最小的元素,故X为H元素;Y的气态氢化物能使湿润的红色石蕊试纸变蓝,故为氨气,则Y为N元素;Z为地壳中含量最多的元素,故为O元素;R与X同主族,且原子序数大于8,故R为Na元素;Y、R、Q最外层电子数之和为8,故Q的最外层有2个电子,且原子序数比11大,故为Mg元素;M的单质黄绿色有害气体,故为Cl元素.
(1)R为Na元素,其原子序数为11,位于周期表中第三周期第IA族,故答案为:第三周期第IA族;
(2)Z、Q、M简单离子分别为O2-、Mg2+、Cl-,而微粒的电子层数越多,则半径越大,故Cl-的半径最大;当电子层数相同时,核电荷数越多,则半径越小,故Mg2+的半径最小,故简单离子半径由大到小的顺序为Cl->O2->Mg2+,故答案为:Cl->O2->Mg2+;
(3)YX4M为NH4Cl,为离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)Q3Y2为Mg2N3,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(5) X、Z两元素形成的原子个数比为1∶1的化合物为H2O2,其结构式为H-O-O-H,故答案为:H-O-O-H;
(6)M的单质即为氯气,与R的最高价氧化物对应的水化物即为NaOH反应,生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案