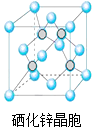
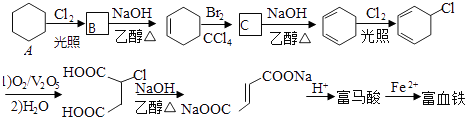
题目内容
【题目】将5.04gNa2CO3、NaOH的固体混合物加水溶解,向该溶液中逐滴加入2molL﹣1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中不正确的是( ) 
A.OA段发生反应的离子方程式为:H++OH﹣═H2O? CO ![]() +H+═HCO3﹣
+H+═HCO3﹣
B.B点溶液中的溶质为NaCl,其质量为5.85g
C.当加入35mL盐酸时,产生CO2的体积为224mL(标准状况)
D.混合物中NaOH的质量2.40g
【答案】D
【解析】解:A.OA段发生反应的离子方程式为:H++OH﹣═H2O、CO ![]() +H+═HCO3﹣ , 故A正确; B.B点为NaCl溶液,n(NaCl)=n(HCl)=2molL﹣1×0.05L=0.1mol,m(NaCl)=0.1mol×58.5g/mol=5.85g,故B正确;
+H+═HCO3﹣ , 故A正确; B.B点为NaCl溶液,n(NaCl)=n(HCl)=2molL﹣1×0.05L=0.1mol,m(NaCl)=0.1mol×58.5g/mol=5.85g,故B正确;
C.AB段发生反应的离子方程式为:HCO ![]() +H+=H2O+CO2↑,根据方程式n(CO2)=(35﹣30)×10﹣3L×2mol/L=0.01mol,所以二氧化碳的体积为:0.01mol×22.4L/mol=224mL,故C正确;
+H+=H2O+CO2↑,根据方程式n(CO2)=(35﹣30)×10﹣3L×2mol/L=0.01mol,所以二氧化碳的体积为:0.01mol×22.4L/mol=224mL,故C正确;
D.由反应HCO ![]() +H+=H2O+CO2↑,n(CO2)=n(Na2CO3)=(50﹣30)×10﹣3×2mol/L=0.04mol,所以氢氧化钠的质量为5.04g﹣0.04×106g=0.8g,故D错误;
+H+=H2O+CO2↑,n(CO2)=n(Na2CO3)=(50﹣30)×10﹣3×2mol/L=0.04mol,所以氢氧化钠的质量为5.04g﹣0.04×106g=0.8g,故D错误;
故选D.

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作及其结论都正确的是( )
Ⅰ操作 | Ⅱ结论 | |
A | 滴加Ba(OH)2溶液生成白色沉淀 | 原溶液中有SO |
B | 滴加AgNO3溶液生成白色沉淀 | 原溶液中有Cl﹣ |
C | 滴加过量浓NaOH溶液并加热,将湿润红色石蕊试纸置于试管口,试纸变蓝色 | 原溶液中有NH |
D | 滴加氯水和CCl4 , 振荡、静置,上层溶液显紫红色 | 原溶液中有I﹣ |
A.A
B.B
C.C
D.D