题目内容
(10分)下表是元素周期表的一部分:
(1)表中元素⑦的氢化物的化学式为 ,此氢化物的还原性比元素⑩的氢化物的还原性 (填强或弱)
(2)某元素原子的M层 p电子数比s电子数少1,则该元素的元素符号是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:
_________________________________________________________________________;
_________________________________________________________________________;
(3)③④⑤的第一电离能由大到小的顺序____________(写元素符号)
(4)表格中电负性最大的元素______,电负性最小的元素_____(写元素符号)
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(2)某元素原子的M层 p电子数比s电子数少1,则该元素的元素符号是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:
_________________________________________________________________________;
_________________________________________________________________________;
(3)③④⑤的第一电离能由大到小的顺序____________(写元素符号)
(4)表格中电负性最大的元素______,电负性最小的元素_____(写元素符号)
(1)HCl 弱
(2)Al Al(OH)3 + 3H+ = Al3+ + 3H2O(2分) Al(OH)3 + OH- = AlO2- + 2H2O(2分)
(3) Si >Mg > Al (4) F K
(2)Al Al(OH)3 + 3H+ = Al3+ + 3H2O(2分) Al(OH)3 + OH- = AlO2- + 2H2O(2分)
(3) Si >Mg > Al (4) F K
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知①是N,②是F,③是Mg,④是Al,⑤是Si,⑥是S,⑦是Cl,⑧Ar,⑨是K,⑩是Br。金属性越强,第一电离能就越小。非金属性越强,电负性越大。金属性越强目的分析越小。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 表示。该元素组成的以下物质,分子式肯定错误的是
表示。该元素组成的以下物质,分子式肯定错误的是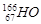 可有效冶疗肝癌,该同位素原子核内的中子数与质子数之差为( )
可有效冶疗肝癌,该同位素原子核内的中子数与质子数之差为( ) X,试根据原子结构理论和元素周期律预测正确的是( )
X,试根据原子结构理论和元素周期律预测正确的是( )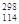 X 位于第七周期,第ⅣB族
X 位于第七周期,第ⅣB族