题目内容
稀氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
已知,25℃时溶液中存在下列关系:K= =1.8×10-5
=1.8×10-5
(1)向稀氨水中通入氨气时,平衡向 移动(用“右”、“左”填空,下同),向稀氨水中加入氢氧化钠时,平衡向 移动。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,所得溶液pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向氨水中加入少量(NH4)2SO4固体,此时溶液中 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(3)25℃时,若氨水的起始浓度为0.5 mol/L,平衡时溶液中c(OH-)=__________________,pH=______;向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)= 。
 NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-已知,25℃时溶液中存在下列关系:K=
 =1.8×10-5
=1.8×10-5(1)向稀氨水中通入氨气时,平衡向 移动(用“右”、“左”填空,下同),向稀氨水中加入氢氧化钠时,平衡向 移动。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,所得溶液pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向氨水中加入少量(NH4)2SO4固体,此时溶液中
 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。(3)25℃时,若氨水的起始浓度为0.5 mol/L,平衡时溶液中c(OH-)=__________________,pH=______;向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)= 。
(共13分)
(1)右 (1分) 左 (1分)
(2)< (1分) NH4++H2O NH3·H2O+H+(2分) 减小(2分)
NH3·H2O+H+(2分) 减小(2分)
(3)3×10-3 mol/L(2分) 11.5 (2分) a/2 mol/L(2分)
(1)右 (1分) 左 (1分)
(2)< (1分) NH4++H2O
 NH3·H2O+H+(2分) 减小(2分)
NH3·H2O+H+(2分) 减小(2分)(3)3×10-3 mol/L(2分) 11.5 (2分) a/2 mol/L(2分)
试题分析:(1)通入氨气,c(NH4+)增大,c(OH-)增大,平衡向右移动。加入氯化铵固体,铵根离子浓度增大,平衡向左移动。
(2)氯化铵是强酸弱碱盐,水解呈酸性,pH<7,离子方程式为NH4++H2O
 NH3·H2O+H+。向氨水中加入少量(NH4)2SO4固体,水解平衡正向移动,故
NH3·H2O+H+。向氨水中加入少量(NH4)2SO4固体,水解平衡正向移动,故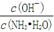 减小。
减小。(3)K=
 =1.8×10-5。c(OH-)=)3×10-3 mol/L。pH=11.5。向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)=a/2 mol/L。
=1.8×10-5。c(OH-)=)3×10-3 mol/L。pH=11.5。向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)=a/2 mol/L。点评:本题考查了电离平衡的移动,根据勒夏特列原理进行分析解答即可,难度不大。

练习册系列答案
相关题目

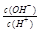 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是