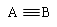题目内容
H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。
 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为:
两者的键能数据:(单位kJ/mol)
|
|
A—B |
A=B |
|
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因 。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
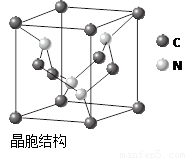
(4)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料。 该物质的化学式为: 。
(8分)
(1)C O N (1分) ;sp3杂化(1分)
(2)CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。(2分)
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,在气化时要破坏氢键,所以需要更多能量,沸点前者较高。
(4)C3N4(2分)
【解析】
试题分析:
(1)由于N原子最外层是半充满结构,能量比较低,难以失电子,所以第一电离能比相邻原子的大,故顺序为C O N ;根据价层电子对互斥理论可以NH4+中氮sp3杂化;
(2)根据表中的数据可知:CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
(4)晶胞中微粒数计算为:碳,8*11/8+4*1/2=3,氮:4个,故化学式为C3N4。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案