题目内容
14.固体NH4Br置于1升的密闭容器中,在恒温条件下存在如下两个可逆反应:NH4Br?NH3+HBr;2HBr?H2+Br25分钟后,测得H2的浓度为1mol/L,HBr的浓度为8mol/L,则上述反应中生成NH3的速率为( )
| A. | 1.2mol•L-1•min-1 | B. | 2mol•L-1•min-1 | ||
| C. | 5mol•L-1•min-1 | D. | 10mol•L-1•min-1 |
分析 反应达到化学平衡,测知H2浓度为1mol•L-1,则消耗的HBr为1mol•L-1×2=2mol•L-1;测知HBr的浓度为8mol•L-1,则NH4Br分解生成的HBr的浓度为2mol•L-1+8mol•L-1=10mol•L-1,故NH4Br分解生成的NH3的浓度为10mol•L-1,根据v=$\frac{△c}{△t}$结合方程式进行计算.
解答 解:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)═Br2(g)+H2(g),
10mol•L-1 10mol•L-1 2mol•L-1 1mol•L-1 1mol•L-1
反应达到化学平衡,测知H2浓度为1mol•L-1,则消耗的HBr为1mol•L-1×2=2mol•L-1;测知HBr的浓度为8mol•L-1,则NH4Br分解生成的HBr的浓度为2mol•L-1+8mol•L-1=10mol•L-1,故NH4Br分解生成的NH3的浓度为10mol•L-1,
故v(NH3)=$\frac{△c}{△t}$=$\frac{10mol/L}{5min}$=2mol•L-1•min-1,
故选B.
点评 本题考查化学反应速率的相关计算,把握化学反应速率的定义为解答的关键,难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+OH-=SO42-+Cl-+H2O | |
| C. | 硫酸工业尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| D. | Cu溶于浓HNO3:Cu+4H++2NO3-=Cu2++2NO↑+4H2O |
14. 常温下,向10mL 0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a,b,c三点的pH为实验所测得.下列有关说法中一定错误的是( )
常温下,向10mL 0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a,b,c三点的pH为实验所测得.下列有关说法中一定错误的是( )
 常温下,向10mL 0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a,b,c三点的pH为实验所测得.下列有关说法中一定错误的是( )
常温下,向10mL 0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a,b,c三点的pH为实验所测得.下列有关说法中一定错误的是( )| A. | 水的电离程度先增大后减小 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
19.下列分离、提纯、鉴别物质的方法正确的是( )
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| B. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| C. | 用过滤的方法除去蔗糖溶液中含有的少量淀粉胶体 | |
| D. | 用加热、过滤、蒸发的方法可以除去粗盐中的泥沙、CaCl2、MgCl2等杂质 |
6.某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A. | X的最高化合价为+4 | |
| B. | X是第二周期VA族元素 | |
| C. | X是第二周VIA族元素 | |
| D. | X的最高价含氧酸的分子式可表示为H3XO4 |
3.纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,某同学推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
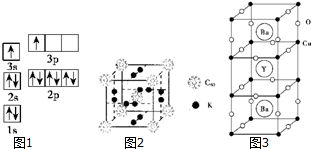
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.A原子杂化类型是sp.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确不正确理由是因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1.晶胞中每个C60分子周围与之等距离且最近的C60分子数是6.
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图3.
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式YBa2Cu3O7.
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比2:1.
③Ba2+的配位数为10.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |

②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.A原子杂化类型是sp.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确不正确理由是因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1.晶胞中每个C60分子周围与之等距离且最近的C60分子数是6.
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图3.
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式YBa2Cu3O7.
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比2:1.
③Ba2+的配位数为10.
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: (1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.
(1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.