题目内容
在1 L的密闭容器中,充入1 mo1CO和1 mo1 H2O (g),于850℃时进行化学反应:CO(g) + H2O (g)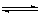 CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
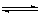 CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是| 时间/min | n(CO)/ mo1 | n(H2O)/mo1 | n(CO2)/ mo1 | n(H2)/ mo1 |
| 0 | 1 | 4 | 0 | 0 |
| 4 | 0.25 | 3.25 | 0.75 | 0.75 |
| 6 | n1 | n2 | n3 | n4 |
| 8 | n1 | n2 | n3 | n4 |
| t | 0.15 | 3.15 | 0.85 | 0.85 |
| A.前4 min,用CO表示的化学反应速率为v(CO)=0.25mol/(L·min) |
| B.反应在第4 min时处于化学平衡状态 |
| C.8分钟时,混合气体中CO2的体积分数为16% |
| D.t分钟时,反应所处的温度高于850℃ |
C
本题关键词为温度不变,平衡常数不变 ,K=1。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2NH3(g)在某温度下达平衡时,各物质的浓度是c(N2)="3" mol ·L-1,c(H2)="9" mol ·L-1,c(NH3)="4" mol ·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是c(N2)="3" mol ·L-1,c(H2)="9" mol ·L-1,c(NH3)="4" mol ·L-1,求该温度时的平衡常数和N2、H2的起始浓度。 bN(g),M、N的物质的量随时间的变化曲线如图所示:
bN(g),M、N的物质的量随时间的变化曲线如图所示:
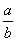 =__________
=__________ 2SO3(g),根据下列要求填写空白:
2SO3(g),根据下列要求填写空白: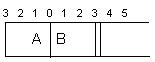
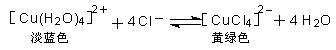
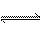
 H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )
H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )  2HI(g)
2HI(g)