题目内容
一定量的氢气与一定量的氯气反应,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol(溶液中只含NaCl和NaClO两种溶质).则下列有关说法不正确的是( )
| A、原NaOH溶液的质量分数为10.0% | B、所得溶液中Cl-的物质的量为0.25mol | C、参加反应的氢气的物质的量为0.1mol | D、所用氯气和参加反应的氢气的物质的量之比为2﹕3 |
分析:所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,
A.根据c=
变形计算原NaOH溶液的质量分数;
B.根据钠离子守恒有:n(NaCl)+n(NaClO)=n(NaOH),据此计算n(NaCl),可得溶液中n(Cl-);
C.溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,计算氯化氢提供的氯离子,进而计算n(HCl),据此计算参加反应的氢气的物质的量;
D.测得反应后溶液中含Cl-、ClO-,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-),根据氯原子守恒可知2n(Cl2)=n(Cl-)+n(ClO-),据此计算原混气体中含有的n(Cl2),再结合C中计算氢气物质的量的解答.
A.根据c=
| 1000ρω |
| M |
B.根据钠离子守恒有:n(NaCl)+n(NaClO)=n(NaOH),据此计算n(NaCl),可得溶液中n(Cl-);
C.溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,计算氯化氢提供的氯离子,进而计算n(HCl),据此计算参加反应的氢气的物质的量;
D.测得反应后溶液中含Cl-、ClO-,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-),根据氯原子守恒可知2n(Cl2)=n(Cl-)+n(ClO-),据此计算原混气体中含有的n(Cl2),再结合C中计算氢气物质的量的解答.
解答:解:A.根据c=
可知,原NaOH溶液的质量分数=
=10%,故A正确;
B.根据钠离子守恒有:n(NaCl)+n(NaClO)=n(NaOH),故n(NaCl)=0.1L×3.00mol/L-0.05mol=0.25mol,反应后溶液中n(Cl-)=0.25mol,故B正确;
C.溶液中含有NaClO的物质的量为0.05mol,根据Cl2+2NaOH═NaCl+NaClO+H2O可知,该反应生成的NaCl为0.05mol,溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为0.25mol-0.05mol=0.2mol,即反应后的混合气体中n(HCl)=0.2molmol,根据氢元素守恒可知,原混合气体中n(H2)=
n(HCl)=
×0.2mol=0.1mol,故C正确;
D.所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,测得反应后溶液中含Cl-、ClO-,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)=0.3mol,根据氯原子守恒可知原混合气体中2n(Cl2)=n(Cl-)+n(ClO-),可知混合气体中n(Cl2)=
×0.3mol=0.15mol,故所用氯气和参加反应的氢气的物质的量之比为0.15mol:0.1mol=3:2,故D错误;
故选:D.
| 1000ρω |
| M |
| 3×40 |
| 1000×1.2 |
B.根据钠离子守恒有:n(NaCl)+n(NaClO)=n(NaOH),故n(NaCl)=0.1L×3.00mol/L-0.05mol=0.25mol,反应后溶液中n(Cl-)=0.25mol,故B正确;
C.溶液中含有NaClO的物质的量为0.05mol,根据Cl2+2NaOH═NaCl+NaClO+H2O可知,该反应生成的NaCl为0.05mol,溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为0.25mol-0.05mol=0.2mol,即反应后的混合气体中n(HCl)=0.2molmol,根据氢元素守恒可知,原混合气体中n(H2)=
| 1 |
| 2 |
| 1 |
| 2 |
D.所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,测得反应后溶液中含Cl-、ClO-,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)=0.3mol,根据氯原子守恒可知原混合气体中2n(Cl2)=n(Cl-)+n(ClO-),可知混合气体中n(Cl2)=
| 1 |
| 2 |
故选:D.
点评:本题考查混合物计算、氧化还原反应的计算等,难度中等,注意从质量守恒的角度结合反应的有关方程式计算,侧重考查学生的思维能力、分析解决问题的能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g) 2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)
 2NH3(g) △H<0 。
2NH3(g) △H<0 。氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:

正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |
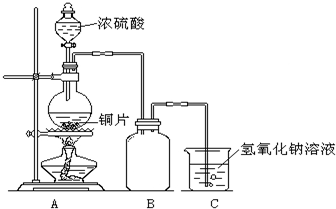 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验: