题目内容
(三选一----化学与技术)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
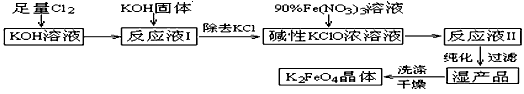
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在__________(填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式________________;
(3)K2FeO4具有强氧化性的原因___________________________;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为_________________;
(5)在“反应液I”中加KOH固体的目的是① ____________, ②____________;
(6)从“反应液II”中分离出K2FeO4后,会有副产品___________(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途_______________________________。
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在__________(填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式________________;
(3)K2FeO4具有强氧化性的原因___________________________;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为_________________;
(5)在“反应液I”中加KOH固体的目的是① ____________, ②____________;
(6)从“反应液II”中分离出K2FeO4后,会有副产品___________(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途_______________________________。
(1)温度较低
(2)2NaCl + 2H2O![]() 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
(3)Fe元素的化合价显+6价,易得电子
(4)10 mol/L
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物
(6)KNO3、KCl;KNO3可用于化肥,炸药等

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
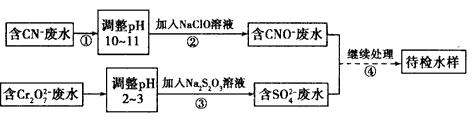
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是____________。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因___________。
(3)②中反应后无气体放出,该反应的离子方程式为________________ 。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol e-,该反应的离子方程式为_______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因________________________。
(1)上述处理废水的流程中主要使用的方法是____________。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因___________。
(3)②中反应后无气体放出,该反应的离子方程式为________________ 。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol e-,该反应的离子方程式为_______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因________________________。
