题目内容
下列说法错误的是( )
| A、石油分馏时温度计水银球位置处在蒸馏烧瓶的支管口附近 |
| B、在葡萄糖溶液中加入硫酸铜溶液,加热,可观察到砖红色沉淀 |
| C、在乙醇中加入钠可产生氢气 |
| D、浓HNO3应保存在棕色试剂瓶中,并贮存在避光、低温处 |
考点:蒸馏与分馏,乙醇的化学性质,葡萄糖的性质和用途,化学试剂的存放
专题:有机化学基础
分析:A.根据蒸馏的原理来确定温度计水银球的位置;
B.NaOH溶液和CuSO4溶液生成氢氧化铜沉淀,溶液呈碱性,醛基能被氢氧化铜氧化生成羧酸,同时生成砖红色氧化铜沉淀;
C.乙醇与钠反应产生氢气;
D.硝酸见光易分解.
B.NaOH溶液和CuSO4溶液生成氢氧化铜沉淀,溶液呈碱性,醛基能被氢氧化铜氧化生成羧酸,同时生成砖红色氧化铜沉淀;
C.乙醇与钠反应产生氢气;
D.硝酸见光易分解.
解答:
解:A.蒸馏的原理:通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口,故A正确;
B.在葡萄糖溶液中加入硫酸铜溶液,加热,不反应,故B错误;
C.乙醇与钠反应产生氢气,故C正确;
D.硝酸见光易分解变质,为了防止分解将硝酸保存于棕色试剂瓶中,并贮存在避光、低温处,故D正确;
故选B.
B.在葡萄糖溶液中加入硫酸铜溶液,加热,不反应,故B错误;
C.乙醇与钠反应产生氢气,故C正确;
D.硝酸见光易分解变质,为了防止分解将硝酸保存于棕色试剂瓶中,并贮存在避光、低温处,故D正确;
故选B.
点评:本题主要考查了常见的实验操作、物质的性质与保存,难度不大,注意知识的积累.

练习册系列答案
相关题目
下列实验能达到实验目的是( )
| A、用100mL容量瓶量取50mL水 |
| B、用四氯化碳萃取碘水中的碘 |
| C、用浓硫酸干燥氨气 |
| D、用pH试纸测定氯水的pH |
下列离子方程式正确的是( )
| A、常温下,将铁片置于过量的浓硝酸中:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | ||||
B、加热条件下,铜与浓硫酸反应:4H++SO42-+Cu
| ||||
| C、常温下,向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | ||||
| D、常温下,向稀硝酸中加入过量的铁片:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、22.4L C2H2中有2NA个π键 |
| B、1mol苯含有碳碳双键的数目为3NA |
| C、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| D、1mol二氧化硅晶体中含Si-O键的数目为2NA |
酸雨是我国较严重的环境污染现象之一,导致酸雨形成的主要物质可能是( )
| A、氟氯烃 |
| B、N2 |
| C、CO2 |
| D、SO2 |
下列说法中正确的是( )
A、
| ||||||
| B、O2与O3互为同位素 | ||||||
| C、CH3-CH2-OH与CH3-O-CH3互为同分异构体 | ||||||
D、CH3-CH2-CH2-CH3与 互为同系物 互为同系物 |
亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图所示下列有关叙述正确的是( )


| A、亮菌甲素分子式为C12H11O5 |
| B、亮菌甲素能与三氯化铁溶液发生显色反应,1mol最多能与5mol H2发生加成反应 |
| C、1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2mol NaOH |
| D、每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
某有机物的结构简式如图所示,下列说法中不正确的是( )
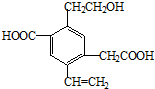

| A、1mol该有机物和过量的金属钠反应最多可以生成1.5mol H2 |
| B、该物质消耗Na、NaOH、NaHCO3的物质的量之比为3:2:2 |
| C、可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
| D、该物质能够在催化剂作用下被氧化为醛 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Ba2+、NO3-、Cl- |
| C、Na+、HCO3-、NO3-、SO42- |
| D、Fe3+、Na+、Cl-、SO42- |