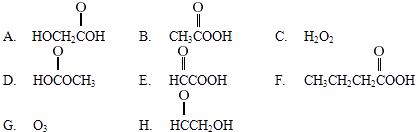题目内容
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式: .
(2)H3PO2中,磷元素的化合价为 .
(3)NaH2PO2是正盐还是酸式盐?其溶液显性(填弱酸性、中性、或者弱碱性).
(4)H3PO2也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):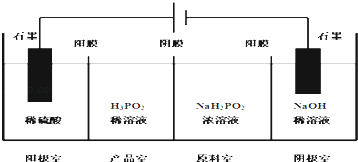
①写出阴极的电极反应式 .
②分析产品室可得到H3PO2的原因 .
③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质.该杂质产生的原因是: .
【答案】
(1)H3PO2?H2PO2﹣+H+
(2)+1
(3)弱碱性
(4)2H++2e﹣=H2↑;阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2;PO43﹣;H2PO2﹣或H3PO2被氧化
【解析】解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2H2PO2﹣+H+ , 所以答案是:H3PO2H2PO2﹣+H+;(2)H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为﹣2价,则P元素的化合价为+1价,所以答案是:+1;(3)由于H3PO2是一元中强酸,所以NaH2PO2为一元强碱和一元中强酸形成的正盐,所以该盐溶液由于成H2PO2﹣发生水解呈弱碱性,方程式为H2PO2﹣+H2OH3PO2+OH﹣ , 所以答案是:正盐;弱碱性;(4)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2﹣ , 其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH﹣﹣4e﹣=O2↑+2H2O,阴极电极反应是溶液中氢离子得到电子发生还原反应,2H++2e﹣=H2↑所以答案是:2H++2e﹣=H2↑;②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2 , 所以答案是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2;③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2﹣或H3PO2氧化成PO43﹣ , 产品中混有PO43﹣ , 所以答案是:PO43﹣;H2PO2﹣或H3PO2被氧化;
【考点精析】解答此题的关键在于理解氮族元素简介的相关知识,掌握原子结构特点相同点:最外层电子数均为5个不同点:电子层数不同.