题目内容
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。?
(2)铝与氢氧化钾溶液反应的离子方程式是 。?
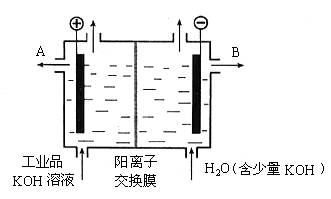
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。?
①该电解槽的阳极反应式是 。?
②通电开始后,阴极附近溶液pH会增大,请简述原因 ?
。
③除去杂质后得氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。?
解析:本题考查的是Al的性质及其制法,以及简单的电解原理,(1)(2)两问都属记忆的内容。(3)中在阳极区是阴离子放电,KOH溶液中的阴离子是OH-,所以其电极反应式为4OH--4e-![]() 2H2O+O2↑。阴极区H+放电:2H++2e-
2H2O+O2↑。阴极区H+放电:2H++2e-![]() H2↑,由于H+放电,导致水的电离程度增大,使OH-浓度增大,又因为阳离子交换膜只允许阳离子通过,所以阴极区的pH会增大。
H2↑,由于H+放电,导致水的电离程度增大,使OH-浓度增大,又因为阳离子交换膜只允许阳离子通过,所以阴极区的pH会增大。
答案:![]() ?
?
(2)2Al+2OH-+2H2O![]() 2
2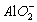 +3H2↑?
+3H2↑?
(3)①4OH--4e-![]() 2H2O+O2↑?
2H2O+O2↑?
②H+放电,促进水电离,OH-浓度增大?
③B

练习册系列答案
相关题目