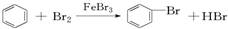题目内容
现有下列九种物质:①H2②铝③CuO④CO2⑤H2SO4⑥Ba(OH)2固体 ⑦氨水⑧稀硝酸
⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为______.
(3)⑨在水中的电离方程式为______,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为______.
(4)少量的④通入⑥的溶液中反应的离子方程式为:______.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是______(填化学式),还原剂与氧化剂的物质的量之比是______,当有5.4gAl发生反应时,转移电子的物质的量为______.
⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ______ | ______ | ______ |
(3)⑨在水中的电离方程式为______,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为______.
(4)少量的④通入⑥的溶液中反应的离子方程式为:______.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是______(填化学式),还原剂与氧化剂的物质的量之比是______,当有5.4gAl发生反应时,转移电子的物质的量为______.
(1)能够导电的物质中存在自由移动的带电粒子,满足该条件的有:②铝、⑦氨水、⑧稀硝酸、⑨熔融Al2(SO4)3;非电解质为在水溶液和熔融状态下都不导电的化合物,满足该条件的为:④CO2;电解质在水溶液或熔融状态下能够导电的化合物,满足条件的有:③CuO、⑤H2SO4⑥Ba(OH)2固体、⑨熔融Al2(SO4)3,
故答案为:
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该反应表示强酸与可溶性的强碱发生中和反应生成可溶性的盐和水,该离子反应对应的化学方程式为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O,
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)硫酸铝在为强电解质,在水溶液中能够完全电离出铝离子和硫酸根离子,其电离方程式为:Al2(SO4)3=2Al3++3SO42-;34.2g⑨硫酸铝的物质的量为:溶于水配成250mL溶液,SO42-的物质的量浓度为:
=0.1mol,0.1mol硫酸铝中含有0.3mol硫酸根离子,配制的溶液中硫酸根离子的物质的量浓度为:
=1.2mol/L,
故答案为:Al2(SO4)3=2Al3++3SO42-;1.2mol/L;
(4)少量的④二氧化碳通入⑥氢氧化钡溶液中,反应生成碳酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O,
故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;
(5)反应Al+4HNO3=Al(NO3)3+NO↑+2H2O中,硝酸中N的化合价由硝酸中的+5变为NO中的+2价,化合价降低被还原,在反应中做氧化剂;该反应中还原剂为金属Al,还原产物为NO,根据化学计量数可知,铝的计量数为1,若1mol铝完全反应,有1mol氧化剂硝酸被还原成一氧化氮,所以氧化剂与还原剂的物质的量之比为1:1;5.4gAl的物质的量为:
=0.2mol,金属铝为3价金属,0.2mol铝完全反应失去0.6mol电子,根据电子守恒,转移的电子的物质的量为0.6mol,
故答案为:HNO3;1:1;0.6mol.
故答案为:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)硫酸铝在为强电解质,在水溶液中能够完全电离出铝离子和硫酸根离子,其电离方程式为:Al2(SO4)3=2Al3++3SO42-;34.2g⑨硫酸铝的物质的量为:溶于水配成250mL溶液,SO42-的物质的量浓度为:
| 34.2g |
| 342g/mol |
| 0.3mol |
| 0.25L |
故答案为:Al2(SO4)3=2Al3++3SO42-;1.2mol/L;
(4)少量的④二氧化碳通入⑥氢氧化钡溶液中,反应生成碳酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O,
故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;
(5)反应Al+4HNO3=Al(NO3)3+NO↑+2H2O中,硝酸中N的化合价由硝酸中的+5变为NO中的+2价,化合价降低被还原,在反应中做氧化剂;该反应中还原剂为金属Al,还原产物为NO,根据化学计量数可知,铝的计量数为1,若1mol铝完全反应,有1mol氧化剂硝酸被还原成一氧化氮,所以氧化剂与还原剂的物质的量之比为1:1;5.4gAl的物质的量为:
| 5.4g |
| 27g/mol |
故答案为:HNO3;1:1;0.6mol.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目