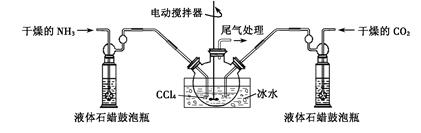
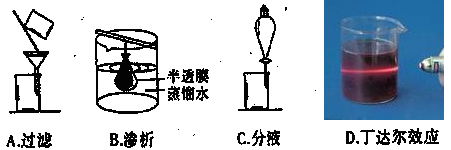
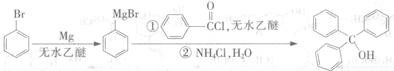
题目内容
下列实验设计能够成功的是
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某卤代烃是否是氯代烃 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去铁屑表面的油污 | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
D
试题分析:A.无法达到实验目的,硝酸可把亚硫酸根离子氧化,错误;B.用硝酸代替硫酸,因为硫酸银也是白色的,错误;C.不应加入HNO3,因为它可以把I-氧化,无法比较H2O2和I2谁的氧化性强,
错误;D.碳酸钠溶液在热的条件下,可以水解为氢氧化钠,油污在氢氧化钠作用下水解,而铁屑和氢氧
化钠不反应。

练习册系列答案
相关题目
 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 )