题目内容
1. 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.已知:2NO2(g)?N2O4(g)△H(298K)=-52.7kJ•mol-1
(1)该化学反应的浓度平衡常数的表达式为K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$.
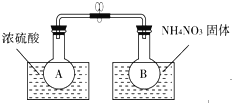
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体.
请回答:
①A中的现象为气体的颜色加深.
②由上述实验现象可知,降低温度,该反应化学平衡向正(选填“正”或“逆”)反应方向移动.
③升高温度,该反应的化学平衡常数将减小(选填“增大”“减小”或“不变”).
分析 (1)化学反应的平衡常数等于各生成物平衡浓度系数次幂之积和各反应物平衡浓度系数次幂之积的比值,据此回答;
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低;
②升高温度平衡向吸热方向移动,降低温度,平衡向放热方向移动;
③根据反应的吸放热确定反应的平衡常数和温度变化之间的关系.
解答 解:(1)化学反应的平衡常数等于各生成物平衡浓度系数次幂之积和各反应物平衡浓度系数次幂之积的比值,即K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,故答案为:K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$;
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:气体颜色加深;
②降低温度,该反应化学平衡移动,即向着正方向移动,故答案为:正;
③反应是放热的,所以升高温度,平衡常数减小,故答案为:减小.
点评 本题考查了温度对化学平衡的影响以及平衡常数的书写和影响因素,难度不大,根据勒夏特里原理来分析解答即可.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
11.下列说法正确的是( )
| A. | 摩尔是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) | |
| D. | 12g碳所含的原子数就是阿伏加德罗常数 |
12.填充下列表格
| 物质 | 粒子数(个) | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| 氦气 | 0.3 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H22O11 | 0.25 |
9.SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
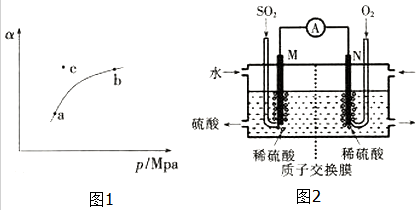
①a、b两点对应的平衡常数K(a)=K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)>c(b).
②c点时,反应速率v(正)<v(逆).
(2)电化学法处理SO2.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为SO2-2e-+2H2O=4H++SO42-.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为0.014L(已知:1个e-所带电量为1.6×10-19C).
(3)溶液法处理SO2.
已知常温下H2SO3和H2CO3的电离常数如表所示:
常温下,将SO2缓慢通入100mL 0.2mol•L-1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为SO2+H2O+CO32-=HCO3-+HSO3-;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
(1)工业制硫酸过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.

①a、b两点对应的平衡常数K(a)=K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)>c(b).
②c点时,反应速率v(正)<v(逆).
(2)电化学法处理SO2.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为SO2-2e-+2H2O=4H++SO42-.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为0.014L(已知:1个e-所带电量为1.6×10-19C).
(3)溶液法处理SO2.
已知常温下H2SO3和H2CO3的电离常数如表所示:
| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
16.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
10.下列关于有机化合物的说法正确的是( )
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 葡萄糖能发生氧化反应和银镜反应 | |
| C. | 乙醇和乙酸都能与氢氧化钠反应 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
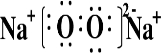 ;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.
;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.