题目内容
已知:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减少20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A.①②④⑤ B.②⑥ C.②③④⑥ D.②④⑥
B
【解析】因为正反应为放热反应,升高温度平衡常数减小,①错;根据表格数据可知,反应转化生成的CH3OCH3、H2O浓度均为1.24 mol·L-1,此时CH3OH的浓度为0.8 mol·L-1,根据Qc= ,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。
,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生
反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
| c(NH3) | c(CO2) |
T1 | 0.1 |
|
T2 |
| 0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得不同时间(t)内产生气体体积(V)的数据如图,根据图示分析实验条件,下列说法中一定不正确的是( )
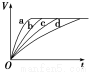
组合 | 对应曲线 | c(HCl)/mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a |
| 30 | 粉末状 |
2 | b |
| 30 | 粉末状 |
3 | c | 2.5 |
| 块状 |
4 | d | 2.5 | 30 | 块状 |
A.第1组实验中盐酸的浓度大于2.5 mol·L-1
B.第2组实验中盐酸的浓度等于2.5 mol·L-1
C.第3组实验的反应温度低于30 ℃
D.第4组实验的反应速率最慢


