题目内容
铝土矿的主要成分是![]() ,还含有
,还含有![]() 、
、![]() 等杂质。
等杂质。
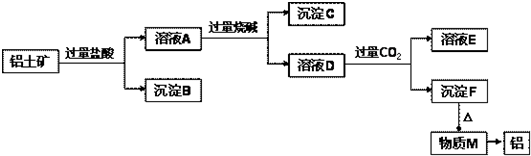
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为 ;每生产0.324吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: ![]()
![]()
![]()
![]()
![]() CO(请配平)
CO(请配平)
②氯化铝与氨气高温合成法:![]()
![]()
![]()
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
Ⅰ、(1)盐酸(硫酸或硝酸)(2分);Al3++3NH3·H2O =Al(OH)3↓+3NH4+(若用Al3+与AlO2-、CO32-、HCO3-反应的正确方程式均可) (3分)(化学式错误和不配平0分,不注明必须的反应条件和不标注沉淀和气体箭头的合并扣1分,下同)
(2)Al2O3中含有SiO2杂质(2分)
Ⅱ、(3)2O2— - 4e-=O2↑(2分) 3.6×104(3分)
Ⅲ、(4) 1 Al2O3 + 3 C + 1 N2 === 2 AlN + 3 CO (2分)
(5) AB(2分,选对一个得1分,错选一个倒扣1分,最少得0分)

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
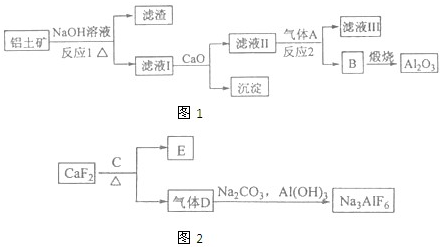
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程: